Sammanhållning
- 3461
- 229
- PhD. Emil Svensson
Vad är sammanhållningskrafter?
De sammanhållningskrafter De är de intermolekylära attraktionskrafterna som håller vissa molekyler med andra. Beroende på sammanhållningskraftens intensitet är ett ämne i fast, flytande eller gasformigt tillstånd. Värdet på sammanhållningskrafter är en inre egenskap hos varje ämne.
Den här egenskapen är relaterad till formen och strukturen för molekylerna i varje ämne. En viktig egenskap hos sammanhållningskrafter är att de minskar snabbt när avståndet ökar. Sedan kallas de sammanhållningskrafter till attraktionskrafterna som förekommer mellan molekylerna i samma substans.
De Avvisande krafter De är de som är resultatet av kinetisk energi (energi på grund av rörelse). Denna energi får molekylerna ständigt i rörelse. Rörelsens intensitet är direkt proportionell mot temperaturen vid vilken ämnet är.
För att orsaka ändring av status för ett ämne är det nödvändigt att höja temperaturen med värmeöverföring. Detta gör att ämnets avvisande krafter ökar, vilket, om tillämpligt, kan hamna på att anta statsförändringen.
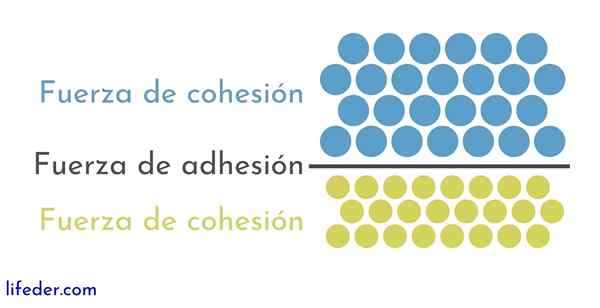
Å andra sidan är det viktigt och nödvändigt att skilja mellan sammanhållning och vidhäftning:
- Sammanhållning beror på attraktionskrafterna mellan angränsande partiklar av samma substans.
- Vidhäftning är resultatet av interaktionen som inträffar mellan ytor av olika ämnen eller kroppar.
Dessa två krafter verkar relaterade till flera fysiska fenomen som påverkar vätskor, så det är viktigt en god förståelse för både en och den andra.
Det kan tjäna dig: Vy Canis Majoris: Discovery, Egenskaper, struktur, träning och utvecklingSammanhållningskrafter i fasta ämnen, vätskor och gaser
 Atomer i de tre huvudstaterna i materien
Atomer i de tre huvudstaterna i materien I fasta ämnen
I allmänhet är sammanhållningskrafter i fasta ämnen mycket höga och ges intensivt i de tre rymdens riktningar.
På detta sätt, om en yttre kraft appliceras på en fast kropp, sker små förskjutningar av molekylerna med varandra.
Dessutom, när den yttre styrkan försvinner, är sammanhållningskrafterna tillräckligt starka för att återgå till molekylerna i sin ursprungliga position och återhämta sig före tillämpningen av styrkan.
I vätskor
Tvärtom, i vätskor är sammanhållningskrafter endast höga i två av de rumsliga riktningarna, medan de är mycket svaga mellan vätskeskikt.
Således, när en kraft appliceras i en tangentiell riktning på en vätska, bryter denna kraft de svaga bindningarna mellan skikten. Detta får vätskeskikten att glida över den andra.
Sedan, när tillämpningen av styrkan avslutas, har sammanhållningskrafterna inte tillräckligt med kraft för att placera de flytande molekylerna i sitt ursprungliga position.
Dessutom återspeglas sammanhållning i vätskor också i ytspänningen, orsakad av en obalanserad kraft riktad mot insidan av vätskan och verkar på ytmolekylerna.
På samma sätt observeras sammanhållning också när övergången från flytande tillstånd till fast tillstånd ges på grund av effekten av kompression av flytande molekyler.
I gaser
I gaser är sammanhållningskrafter föraktliga. På detta sätt är gasmolekylerna i konstant rörelse, eftersom sammanhållningskrafterna i deras fall inte kan hålla dem kopplade till varandra.
Kan tjäna dig: Mekanisk fördel: Formel, ekvationer, beräkning och exempelDärför kan sammanhållningskrafter i gaserna endast ses när kondenseringsprocessen inträffar, som äger rum när de gasformiga molekylerna komprimeras och attraktionens krafter är tillräckligt starka för att producera övergången av tillståndet gasformigt till vätsketillståndet.
Exempel på sammanhållningskrafter
Ofta kombineras sammanhållningskrafterna med vidhäftningskrafterna för att ge upphov till vissa fysiska och kemiska fenomen.
Till exempel tillåter sammanhållningskrafter tillsammans med vidhäftning att förklara några av de vanligaste fenomenen som förekommer i vätskor; Detta är fallet med menisk, ytspänning och kapillaritet.
I fallet med vätskor är det därför nödvändigt att skilja mellan sammanhållningskrafterna, som förekommer mellan molekylerna i samma vätska; och vidhäftning, som förekommer mellan vätskans molekyler och det fasta ämnet.
Ytspänning

Ytspänningen är den kraft som inträffar tangentiellt och per längdenhet på kanten av den fria ytan på en vätska som är i jämvikt. Denna kraft samarbetar vätskesytan.
I slutändan inträffar ytspänning eftersom krafterna som förekommer i vätskemolekylerna är olika på vätskans yta än de som förekommer inuti.
Menisk
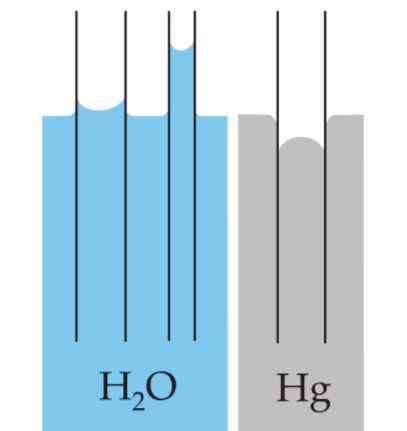
Krökningen som skapas på vätskans yta kallas menisk när den är begränsad i en behållare. Denna kurva produceras av den effekt som behållarens yta har på vätskan som innehåller den.
Kan tjäna dig: tryckmätareKurvan kan vara konvex eller konkav, beroende på om kraften mellan vätskans molekyler och behållaren är av attraktion - som är fallet med vatten och glas - eller är av avstötning, som är fallet mellan kvicksilver och glas.
Kapillaritet
 Exempel på kapillaritet
Exempel på kapillaritet Kapillaritet är en egenskap hos vätskor som gör att de kan stiga upp eller stiga ner genom ett kapillärrör. Det är den egendom som delvis tillåter ökningen av vatten i växterna.
En vätska stiger upp genom kapillärröret när sammanhållningskrafterna är lägre än vidhäftningen mellan vätskan och rörväggarna. På detta sätt kommer vätskan att fortsätta att stiga tills värdet på ytspänningen är lika med vätskans vikt som finns i kapillärröret.
Tvärtom, om sammanhållningskrafterna är högre än vidhäftningen kommer ytspänningen att gå ner till vätskan och formen på ytan kommer att vara konvex.
Referenser
- Sammanhållning (kemi) (n.d.). I Wikipedia. Hämtas från.Wikipedia.org.
- Ytspänning (n.d.). I Wikipedia. Hämtas från.Wikipedia.org.
- Kapillaritet (n.d.). I Wikipedia. Återhämtad från ES.Wikipedia.org.
- Iran. Levine; "Fysikokemi" volym 1; Femte upplagan; 2004; MC Graw Hillm.
- Moore, John W.; Stanitski, Conrad L.; Jurs, Peter C. (2005). Kemi: Molekylärvetenskapen. Belmont, CA: Brooks/Cole.
- Vit, Harvey och. (1948). Modern högskolefysik. Skåpnostrand.


