Kvicksilverhydroxidstruktur, egenskaper, användningar, risker
- 2564
- 610
- Johan Eriksson
han Kvicksilverhydroxid Det är en oorganisk förening där kvicksilvermetallen (Hg) har ett oxidationsnummer på 2+. Dess kemiska formel är Hg (OH)2. Men denna art har ännu inte erhållits i fast form under normala förhållanden.
Kvicksilver eller kvicksilverhydroxidhydroxid är en övergående kort livslängd i bildningen av hgo kvicksilveroxid i alkalisk lösning. För studier som genomförts i HGO Mercuric Oxide Solutions har det härledts att Hg (OH)2 Det är en svag bas. Andra arter som följer med det är hgoh+ och hg2+.
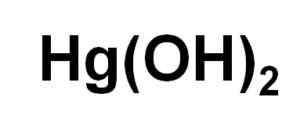 Kemisk formel för kvicksilverhydroxid (II). Författare: Marilú Stea.
Kemisk formel för kvicksilverhydroxid (II). Författare: Marilú Stea. Trots att de inte kan fällas ut i vattenlösning, Hg (OH)2 Det har erhållits genom fotokemisk reaktion av kvicksilver med väte och syre vid mycket låga temperaturer. Det har också erhållits i form av en samutfällning tillsammans med tron (OH)3, där närvaron av halurojoner utövar påverkan på det pH där samutfällning inträffar.
Eftersom det inte lätt har erhållits rent på laboratorienivå har det inte varit möjligt att hitta någon nytta för denna förening, eller bestämma riskerna för dess användning. Det kan emellertid dras att det utgör samma risker som de andra kvicksilverföreningarna.
[TOC]
Molekylstruktur
Strukturen för kvicksilverhydroxid (ii) Hg (OH)2 Det är baserat på en linjär central del bildad av kvicksilveratomen med de två syreatomerna till sidorna.
Väteatomerna är förenade till denna centrala struktur, var och en bredvid varje syre, som vänder fritt runt varje syre. Det kan representeras på ett enkelt sätt som anges nedan:
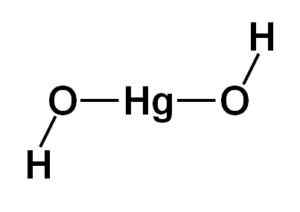 Teoretisk struktur av kvicksilverhydroxid (II). Författare: Marilú Stea
Teoretisk struktur av kvicksilverhydroxid (II). Författare: Marilú Stea Elektronisk konfiguration
Den elektroniska strukturen hos den metalliska kvicksilver HG är som följer:
[XE] 5d10 6s2
där [XE] är den elektroniska konfigurationen av ädla gas Xenon.
Vid observation av denna elektroniska struktur härleds det att det mest stabila oxidationstillståndet för kvicksilver är det där de två elektronerna i skikt 6 går förlorades.
I Hg (OH) kvicksilverhydroxid2, Kvicksilveratom (Hg) finns i dess oxidationstillstånd 2+. Därför i Hg (OH)2 Kvicksilver har följande elektroniska konfiguration:
Det kan tjäna dig: 30 användningar av karboxylsyror i vardagen[XE] 5d10
Nomenklatur
- Kvicksilverhydroxid (II)
- Kvicksilverhydroxid
- Kvicksilverdihydroxid
Egenskaper
Molekylvikt
236,62 g/mol
Kemiska egenskaper
Enligt informationen som konsulterats är det möjligt att HG (OH)2 Vara en övergående förening i bildningen av HGO i alkaliskt vattenhaltigt medium.
Tillsatsen av hydroxyljoner (OH-) till en vattenlösning med kvicksilverjoner Hg2+ Det leder till utfällning av en gul fast kvicksilveroxid (ii) Hgo, av vilken Hg (OH)2 Det är en passagerare eller tillfällig agent.
 Kvicksilveroxid (II). Leiem [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenser/BY-SA/3.0)]. Källa: Wikipedia Commons.
Kvicksilveroxid (II). Leiem [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenser/BY-SA/3.0)]. Källa: Wikipedia Commons. I vattenlösning Hg (OH)2 Det är en mycket kort livslängd, eftersom den snabbt släpper ut en vattenmolekyl och fäller ut den fasta hgo.
Även om det inte har varit möjligt att fälla ut kvicksilverhydroxid Hg (OH)2, Kvicksilveroxid (ii) HGO är något lösligt i vatten som bildar en lösning av arter som kallas "hydroxider".
Dessa arter i vatten som kallas "hydroxider" är svaga baser och även om de ibland uppför sig som amfotorater, i allmänhet Hg (OH)2 Det är mer grundläggande än syra.
När hgo upplöses i hclo4 Studier indikerar närvaron av kvicksilverjon Hg2+, En hgoh monohydroximexurojon+ och Hg (OH) kvicksilverhydroxid2.
De balanser som förekommer i sådana vattenhaltiga lösningar är följande:
Hg2+ + H2Eller ⇔ hgoh+ + H+
Hgoh+ + H2Eller ⇔ hg (oh)2 + H+
I NaOH alkaliska lösningar bildas arten Hg (OH)3-.
Erhållande
Ren kvicksilverhydroxid
Kvicksilverhydroxid (ii) Hg (OH)2 Det kan inte erhållas i vattenlösning, för genom att tillsätta alkali till en lösning av Hg -handelsjoner2+, fälla ut den gula kvicksilveroxiden.
Vissa forskare lyckades dock få 2005 för första gången HG (OH) Mercuric Hydroxide2 Använda en kvicksilverbågslampa, från kvicksilver Hg -elementet, väte h2 och syre eller2.
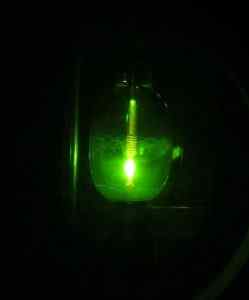 Kvicksilverlampa. D-Kuru [CC BY-SA 2.0 på (https: // CreativeCommons.Org/licenser/BY-SA/2.0/at/gärning.i)]. Källa: Wikipedia Commons.
Kvicksilverlampa. D-Kuru [CC BY-SA 2.0 på (https: // CreativeCommons.Org/licenser/BY-SA/2.0/at/gärning.i)]. Källa: Wikipedia Commons. Reaktionen är fotokemisk och utfördes i närvaro av neon, argon eller fast deuterium vid mycket låga temperaturer (cirka 5 K = 5 grader Kelvin). Beviset för sammansättning av förening erhölls genom IR -ljusabsorptionsspektra (infraröd).
Kan tjäna dig: utfällningHg (OH)2 beredd på detta sätt är mycket stabilt under erfarenhetsförhållandena. Det uppskattas att den fotokemiska reaktionen fortsätter genom O-HG-O-mellanhanden till den stabila molekylen H-O-HG-O-H.
CopRecipitation med järnhydroxid (III)
Om kvicksilver sulfat (ii) Hgso upplöses4 och järnsulfat (iii) tro2(SW4)3 I vattenhaltig lösning, och pH börjar ökas genom att tillsätta en NaOH -natriumhydroxidlösning, efter en vilotid är ett fast ämne som härleds bildas en samutfällning Hg (OH)2 och tro (OH)3.
Det har visat sig att bildningen av Hg (OH)2 Det är ett kritiskt steg i denna samutfällning med tro (OH)3.
Bildandet av Hg (OH)2 I fällningen tron (OH)3-Hg (OH)2 Det beror starkt på närvaron av joner såsom fluorid, klorid eller bromid, på den specifika koncentrationen av dessa och lösningens pH.
I närvaro av fluorid (f-), Ett pH större än 5, samutfällning av Hg (OH)2 Med tro (OH)3 påverkas inte. Men till ett pH av 4 bildandet av komplex mellan HG2+ och f- stör störningen av Hg (OH)2.
När det gäller närvaron av klorid (CL-), CopRecipitation of Hg (OH)2 Det inträffar till ett pH på 7 eller högre, det vill säga helst i alkaliskt medium.
När bromiden är närvarande (BR-), CopRecipitation of Hg (OH)2 Det verkar vid ännu större pH, det vill säga pH över 8,5 eller mer alkaliskt än med klorid.
Ansökningar
Från granskningen av tillgängliga informationskällor följer det att kvicksilverhydroxid (ii) Hg (OH)2, Att vara en förening som ännu inte är beredd kommersiellt, har den inga kända användningsområden.
Nyliga studier
Genom beräkningssimuleringstekniker studerades 2013 De strukturella och energikänner relaterade till Hg (OH) hydrering2 I ett gasformigt tillstånd.
Metall-ligando-koordination och solvationsenergier beräknades och jämfördes genom att variera graden av Hg (OH) hydrering2.
Det konstaterades bland annat att det teoretiska oxidationstillståndet uppenbarligen är 1+ istället för de påstådda 2+ som vanligtvis tilldelades för Hg (OH)2.
Kan tjäna dig: teoretisk prestandaRisker
Även om Hg (OH)2 Som sådan har inte isolerats i tillräcklig kvant.
Det kan vara giftigt för nervsystemet, matsmältningssystemet, huden, ögonen, andningsorganen och njurarna.
Inandning, intag eller kontakt med huden på kvicksilverföreningar kan orsaka skador som sträcker sig från irritationen i ögon och hud, sömn.
Kvicksilver har erkänts internationellt som ett förorenande medel. De flesta kvicksilverföreningar som kommer i kontakt med miljön metyleras av de bakterier som finns i jord och sediment och bildar metylkvicksilver.
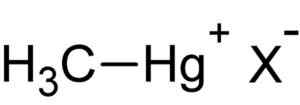 Metylkvicksilver. Författare: Uppladdad av användare: Rifleman 82. Källa: Okänd. Källa: Wikipedia Commons.
Metylkvicksilver. Författare: Uppladdad av användare: Rifleman 82. Källa: Okänd. Källa: Wikipedia Commons. Denna förening är bioackumula i levande organismer, som passerar från marken till växterna och därifrån till djuren. I vattenmiljön är överföringen ännu snabbare och passerar från mycket små arter till de stora på kort tid.
Metylkvicksilver har en toxisk effekt för levande varelser och särskilt för människan, som intar det genom livsmedelskedjan.
När det intas med mat är särskilt skadligt för små barn och foster hos gravida kvinnor, eftersom att vara ett neurotoxin kan orsaka hjärnskador och nervsystemet i bildning och tillväxt.
Referenser
- Bomull, f. Albert och Wilkinson, Geoffrey. (1980). Avancerad oorganisk kemi. Fjärde upplagan. John Wiley & Sons.
- Wang, Xuefeng och Andrews, Lester (2005). Infraröd spektrum av Hg (OH)2 i solid neon och argon. Oorganisk kemi, 2005, 44, 108-113. Återhämtat sig från pubar.ACS.org.
- Amaro-ESTRADA, J.Yo., et al. (2013). Vattenhaltig solvation av Hg (OH)2: Energisk och dynamisk densitet Funktionell teoristudier av HG (OH)2-(H2ANTINGEN)n (N = 1-24) strukturer. J. Fysik. Kem. Till 2013, 117, 9069-9075. Återhämtat sig från pubar.ACS.org.
- Inoue, Yoshikazu och Munemori, Makoto. (1979). Coprecipitation av kvicksilver (ii) med järn (iii) hydroxid. Miljövetenskap och teknik. Volym 13, nummer 4, april 1979. Återhämtat sig från pubar.ACS.org.
- Chang, L.W., et al. (2010). Nervsystem och beteendetikologi. I förståelse för toxikologi. Återhämtat sig från Scientedirect.com.
- Haney, Alan och Lipsey, Richard L. (1973). Ackumulering och effekter av metylkvicksilverhydroxid i en terrestrarisk livsmedelskedja under laboratoriekonditioner. Miljö. Förorenad. (5) (1973) sid. 305-316. Återhämtat sig från Scientedirect.com.
- « Flavin adenin Dinukleotid (FAD) egenskaper, biosyntes
- Glyceraldehyd 3-fosfat (G3P) struktur, funktioner »

