Avogadrolag
- 2125
- 439
- Lars Eriksson
Vad är Avogadros lag?
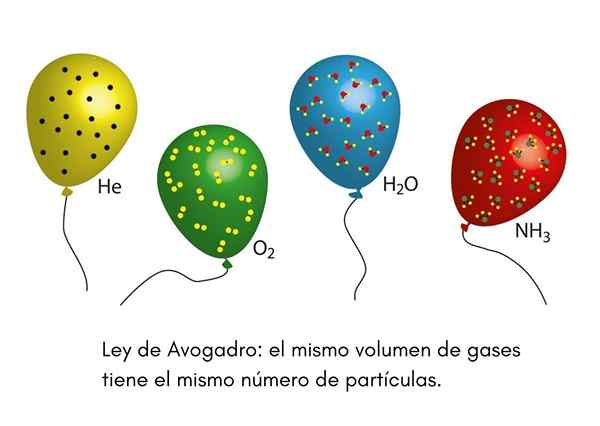
De Avogadrolag, Även kallad Avogadro Principle, det är en lag som gäller idealiska gaser och uttalades av en nittonde århundradet som heter Amadeo Avogadro. Denna lag konstaterar att två lika stora volymer av olika gaser som är i samma temperatur- och tryckförhållanden, kommer att innehålla samma antal gasformiga partiklar.
Detta innebär att om vi har två ballonger, en full med helium och den andra med syre, och båda ballongerna har samma volym, samma tryck och samma temperatur, kommer det att finnas samma antal gasformiga heliumatomer i den första Globe That Oxygen Molecules i den andra.
Avogadro lagformel
Ett annat sätt att ange Avogadros lag är att säga att om konstant tryck och temperatur upprätthålls kommer volymen på en gas att vara proportionell mot antalet mol. Detta representeras på ett matematiskt sätt som:
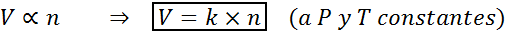
Denna formel kan omarrangeras till V/N = K, det vill säga att förhållandet mellan volymen och antalet mol förblir konstant när P och T är konstant.
Så om vi introducerar eller tar bort en viss gas från en behållare som håller P och T konstant kommer volymen att ändras och det initiala och slutliga tillståndet kommer att relateras med hjälp av följande ekvation:

Villkor enligt vilka Avogadros lag uppfylls
Denna lag gäller exakt idealiska gaser. Dessa är gaser som bildas av specifika partiklar (som inte upptar en volym i rymden) som inte interagerar med varandra på något sätt.
Det kan tjäna dig: Biodiesel: Historia, egenskaper, typer, fördelar, nackdelarSom namnet antyder finns denna typ av gas inte i verkligheten utan i vår fantasi. De är en förenklad "idé" om vad vi tror är en gas. Det finns emellertid vissa förhållanden under vilka en verklig gas, som luft, uppför sig idealiskt: vid mycket låga tryck och vid mycket höga temperaturer.
Det låga trycket gör att den volym som upptar av gaspartiklarna är försumbara jämfört med behållarens storlek, medan de höga temperaturerna gör att partiklarna rör sig så snabbt att de inte har tid att interagera när de korsar med varandra.
Under dessa förhållanden uppfyller de flesta gaser Avogadros lag med god noggrannhet.
Betydelsen av Avogadros lag
Ett av de viktigaste bidragen från Avogadros lag var att den fick visa förekomsten av elementära gaser som bildats av mer än en atom som O2 eller h2. Detta bidrog till framsteget av atomteorin.
Dessutom kompletterar Avogadros lag lagarna om Boyle, Charles och Gay-Lussac, och kombinerar den med dessa tre lagar, tillåter Avogadros lag lagen om idealiska gaser, en av de viktigaste lagarna inom kemi.
Å andra sidan tillåter Avogadros lag också att upprätta förhållanden mellan molekylvikter hos olika gaser, eftersom det innebär att massan av lika stora volymer av olika gaser uppmätta vid samma temperatur och tryck, är proportionell mot massan för varje partikel i varje gas.
Kan tjäna dig: natriumnitrat (nano3): struktur, egenskaper, användningar, riskerSå med enstaka ångerprover av två gaser som upptar volymer som är lika med samma temperatur och tryck, kan förhållandet mellan dess molmassor erhållas.
Exempel på Avogadros lag i vardagen
Festballonger
Vi har någonsin sett en clown på ett barnfest som blåser upp heliumballonger för att distribuera dem bland barnen. Dessa ballonger har ungefär samma temperatur. Om två partiballonger är fyllda vid samma tryck och båda är i samma storlek, säkerställer Avogadros lag att båda ballongerna kommer att ha samma antal heliummullvader.
Å andra sidan, om en av ballongerna är större än den andra, kommer den att ha en större volym och enligt Avogadros lag kommer den att ha en större mängd heliumpartiklar inuti.
Däcken på en bil
Oavsett vilken gas de är fyllda fylls alltid däcken på motsatta sidor av en bil till samma sluttryck på cirka 32 psi.
Dessutom ser vi alltid till att båda gummierna är desamma, så de kommer att ha samma volym. Enligt Avogadro -principen kan vi alltså säga att båda däcken kommer att innehålla samma antal gasformiga partiklar.
En spruta full av luft
Anta att vi har en öppen spruta och full av 50 cm3 luft. Som är öppet är interiören i sprutan och utsidan (omgivningen) vid samma temperatur och tryck.
Anta nu att vi trycker på sprutkolven och flyttar den tills 10 cm har lästs3. När sprutan upptäcks flyr luften genom spetsen när kolven rör sig, så antalet luftpartiklar inuti sprutan minskar tillsammans med volymen.
Kan tjäna dig: förångningEftersom varken trycket eller temperaturen förändras kan avogadrolagen tillämpas för att relatera den slutliga volymen till mängden luftpartiklar som finns kvar i sprutan. Detta förhållande är:

Omarrangera denna ekvation får vi det:
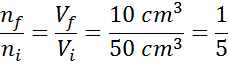
Detta resultat innebär att om vi minskar volymen inuti sprutan till femte, att hålla P och T konstant, kommer antalet mol eller partiklar som finns i slutet av processen också att vara den femte delen av det som ursprungligen hade.


