Kvantmekanisk modell av atomen

- 1649
- 54
- Johan Johansson
Vad är den kvantmekaniska modellen för atomen?
han Kvantmekanisk modell av atomen Den antar att detta bildas av en central kärna bildad av protoner och neutroner. Elektronerna, med negativ belastning, lindrar kärnan i diffusa regioner som kallas orbitaler.
Formen och förlängningen av elektroniska orbitaler bestäms av flera storlekar: kärnpotentialen och kvantiserade nivåer av energi och vinkelmoment för elektroner.
 Figur 1. Modell av en heliumatom enligt kvantmekanik. Det består av sannolikhetsmoln för de två heliumelektronerna som omger en positiv kärna 100 tusen gånger mindre. Källa: Wikimedia Commons.
Figur 1. Modell av en heliumatom enligt kvantmekanik. Det består av sannolikhetsmoln för de två heliumelektronerna som omger en positiv kärna 100 tusen gånger mindre. Källa: Wikimedia Commons. Enligt kvantmekanik har elektroner dubbla vågpartikelbeteende och atomskala är diffusa och icke-specifika. Atomens dimensioner bestäms praktiskt taget av förlängningen av elektroniska orbitaler som omger den positiva kärnan.
Figur 1 visar strukturen för heliumatomen, som har en kärna med två protoner och två neutroner. Denna kärna är omgiven av sannolikhetsmoln för de två elektronerna som omger kärnan, som är hundra tusen gånger mindre. I följande bild kan du se heliumatomen, med protoner och neutroner i kärnan och elektronerna i orbitaler.

Storleken på en heliumatom är i storleksordningen angström (1 Å), det är 1 x 10^-10 m. Medan storleken på dess kärna är i storleksordningen femtometer (1 fm), det vill säga 1 x 10^-15 m.
Trots att den är så liten jämförelsevis är 99,9% av atomvikten koncentrerad i den lilla kärnan. Detta beror på att protoner och neutroner är 2 000 gånger tyngre än elektronerna som omger dem.
Kan tjäna dig: de 31 typerna av kraft i fysik och deras egenskaperAtomskala och kvantbeteende
Ett av de koncept som hade mest inflytande på utvecklingen av atommodellen var dualiteten Våg - partikel: Upptäckten att varje materialobjekt har en våg av materia associerade.
Formeln som gör att våglängden kan beräknas λ ASSEKTATION MED EN MATERIAL FÖRETAG föreslogs av Louis de Broglie 1924 och är som följer:
λ = h / (m v)
Var h Det är Plancks konstant, m degen och v fart.
Enligt De Broglies princip har varje objekt ett dubbelt beteende, men beroende på omfattningen av interaktioner, hastighet och massa, kan vågbeteende vara mer framstående än partikel eller vice versa.
Elektronen är lätt, dess massa är 9,1 × 10^-31 kg. Den typiska hastigheten för en elektron är 6000 km/s (femtio gånger mindre än ljusets hastighet). Denna hastighet motsvarar energevärden i intervallet av dussintals elektronvoltio.
Med tidigare data och genom att använda de Broglie -formeln kan våglängden för elektronen erhållas:
λ = 6,6 x 10^-34 j s / (9,1 × 10^-31 kg 6 x 10^6 m / s) = 1 x 10^-10 m = 1 Å
Elektronen till de typiska energierna i atomnivåerna har en våglängd av samma storleksordning som den för den atomiska skalan, så att den på den skalan har ettdulatoriskt och inte partikelbeteende.
Första kvantmodeller
Med tanken i åtanke att Atomic Scale Electron har böljande beteende utvecklades de första atommodellerna baserade på kvantprinciper. Bland dessa sticker Bohrs atommodell ut, vilket perfekt förutspådde väteutsläppsspektrumet, men inte det för andra atomer.
Kan tjäna dig: Spänningsinsats: Formel och ekvationer, beräkning, övningarBohrs modell och därefter den från Sommerfeld, var semi-klassiska modeller. Det vill säga elektronen var som en partikel utsatt för den elektrostatiska attraktionskraften i kärnan som kretsar runt den, styrd av Newtons andra lag.
Förutom de klassiska banorna tog dessa första modeller hänsyn till att elektronen hade en tillhörande materialvåg. Endast de banor vars omkrets var ett heltal av våglängder tilläts, eftersom de som inte uppfyller detta kriterium bleknat av destruktiv störning.
Det är då kvantiseringen av energi i atomstrukturen visas för första gången.
Ordet kvant exakt kommer från det faktum att elektronen bara kan ta några diskreta energievärden inom atomen. Detta sammanfaller med Plancks konstaterande, som bestod av upptäckten att en frekvensstrålning F Interagera med materia i energipaket E = h f, var h Det är Plancks konstant.
Omloppsform och storlek
Orbitalens radiella räckvidd bestäms av radivågfunktiontill. Är större i den utsträckning som elektronens energi växer, det vill säga i den utsträckning som huvudantumret ökar.
Det radiella avståndet mäts vanligtvis i BOHR-radioapparater, vilket för den lägsta väteenergin är 5,3 x 10-11 m = 0,53 Å.
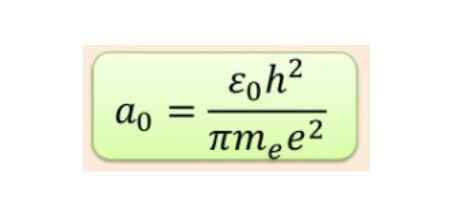 figur 2. BOHR RADIUS Formel. Källa: f. Zapata.
figur 2. BOHR RADIUS Formel. Källa: f. Zapata. Men formen av orbitalerna bestäms av värdet på kvantantalet vinkelmoment. Om l = 0 har du en sfärisk orbital som kallas S, om l = 1 har du en lobad orbital kallad p, som kan ha tre orienteringar enligt det magnetiska kvantantalet. Följande figur visar formen av orbitalerna.
Kan tjäna dig: vektorstorlek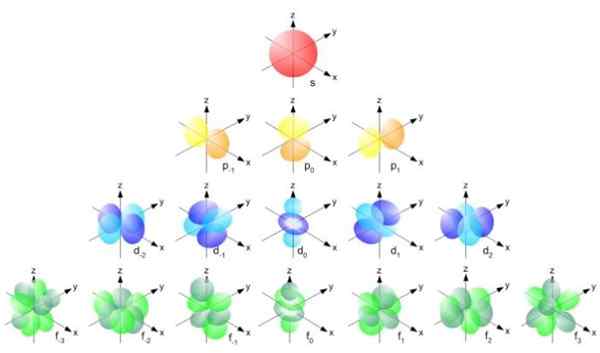 Figur 3. Form av orbitalerna S, P, D, F. Källa: Ucdavis Chemwiki.
Figur 3. Form av orbitalerna S, P, D, F. Källa: Ucdavis Chemwiki. Dessa orbitaler är förpackade inom andra enligt elektronernas energi. Följande figur visar till exempel orbitalerna i en natriumatom.
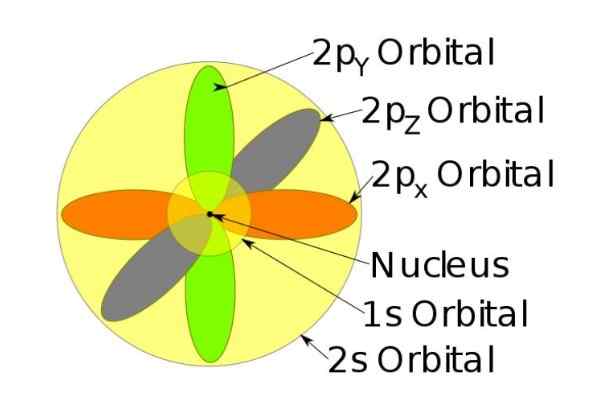 Figur 4. Orbital 1s, 2s, 2p av natriumjonen när den har tappat en elektron. Källa: Wikimedia Commons.
Figur 4. Orbital 1s, 2s, 2p av natriumjonen när den har tappat en elektron. Källa: Wikimedia Commons. Snurr
Den kvantmekaniska modellen för Schrödinger -ekvationen innehåller inte elektronspinnen. Men Pauli beaktas genom uteslutningsprincipen, vilket indikerar att orbitalerna kan fylla upp till två elektroner med kvantspinnnummer s = +½ och s = -½.
Till exempel har natriumjonen 10 elektroner, det vill säga om vi hänvisar till föregående figur finns det två elektroner för varje omlopp.
Men om det är den neutrala natriumatomen finns det 11 elektroner, varav den sista skulle uppta en 3S -orbital (som inte visas i figuren och av större radie än 2s). Atomens snurr är avgörande i ett ämnenas magnetiska egenskaper.
Referenser
- Alonso - Finn. Kvant- och statistiska grunder. Addison Wesley.
- Eisberg - resnick. Kvantfysik. Limusa - Wiley.
- Bensinv. Kvantfysik. John Wiley & Sons.
- Hsc. Fysikkurs 2. Jacaranda Plus.
- Wikipedia. Schrodinger atommodell. Återhämtat sig från: Wikipedia.com

