Blynitratstruktur, egenskaper, erhållning, användning

- 2952
- 524
- Hans Olsson
han blynitrat O blynitrat (ii) är en oorganisk förening bildad av blyelement (Pb), kväve (N) och syre (O). Bly finns som jon pb2+ Och kväve och syre bildar nitratjonen3-.
Dess kemiska formel är PB (nej3)2. Det är ett vitt kristallint fast ämne mycket lösligt i vatten, där det bildar Pb -joner2+ och inte3-. Det är också känt som Plumbose Nitrate eftersom bly är i sitt lägsta oxidationstillstånd.
 Solid blynitrat. Ondřej Mangl / Pub Domain. Källa: Wikimedia Commons.
Solid blynitrat. Ondřej Mangl / Pub Domain. Källa: Wikimedia Commons. Det har starkt oxiderande egenskaper, så det används i applikationer där denna egenskap krävs, till exempel vid framställning av olika organiska föreningar och som ett laboratorieflöpare.
Tidigare användes det allmänt för att förbereda blybaserade färger, där det också fungerade som en fixer av färgerna i vävnaderna. Denna applikation övergavs på grund av ledtoxicitet.
Det har använts i den metallurgiska industrin på olika sätt, och nyligen har dess användbarhet visat sig bildas, tillsammans med andra föreningar, material med hög ljusabsorptionskapacitet och omvandling av detta i elektricitet.
Det är emellertid ett farligt ämne eftersom det kan gynna brandproduktion. Det är också giftigt för människor, djur och växter, så det bör aldrig kasseras i miljön.
[TOC]
Strukturera
Det är en jonisk förening bildad av en pb -katjon2+ och två anjoner nej3-. I nitratanjonen är syre ordnade symmetriskt runt kväve och alternativ dubbelbindning med detta.
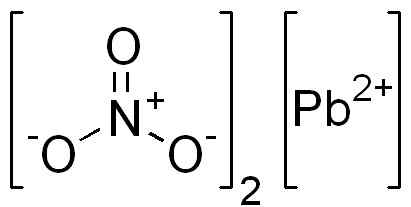 PB -struktur (nej3)2. Edgar181 / pubdomän. Källa: Wikimedia Commons.
PB -struktur (nej3)2. Edgar181 / pubdomän. Källa: Wikimedia Commons. 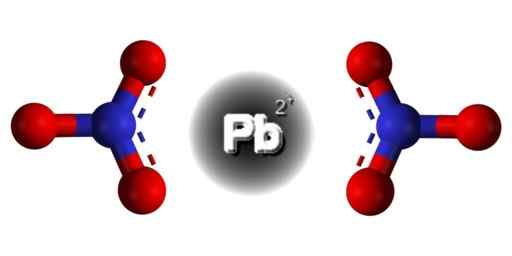 Rumslig struktur av PB (nr3)2. Grå = bly; blå = kväve; Röd = syre. Claudio Pistilli/CC BY-S (https: // Creativecommons.Org/licenser/BY-SA/4.0). Källa: Wikimedia Commons.
Rumslig struktur av PB (nr3)2. Grå = bly; blå = kväve; Röd = syre. Claudio Pistilli/CC BY-S (https: // Creativecommons.Org/licenser/BY-SA/4.0). Källa: Wikimedia Commons. Lead i denna förening har följande elektroniska konfiguration:
[XE] 4F14 5d10 6s2 6p0, där det observeras att det har tappat de två elektronerna i det sista lagret.
Kan tjäna dig: vad är det mest elektronegativa elementet och varför?Nomenklatur
- Blynitrat
- Blynitrat (ii)
- Plumbosnitrat
- Blyminitrat
Egenskaper
Fysiskt tillstånd
Vit eller färglöst kristallint fast ämne. Kubikkristaller.
Molekylvikt
331 g/mol
Smältpunkt
470 ºC. Enligt vissa källor sönderdelas den vid denna temperatur.
Densitet
4,53 g/cm3
Löslighet
Mycket lösligt i vatten: 59,7 g/100 ml vatten vid 25 ° C. Något lösligt i etanol. Olöslig i salpetersyra (HNO3) koncentrerad.
pH
En vattenlösning med 20% PB (nej3)2 Den har ett pH på 3,0-4,0.
Kemiska egenskaper
Är ett oxiderande medel. Reagerar våldsamt med brännbara material och reducerare.
Det är inte bränsle men kan påskynda förbränningen av material som är. Om du värmer upp till dess sönderdelning avger giftiga kväveoxidgaser:
2 PB (nej3)2 + Värme → 2 PBO + 4 Nej2↑ + O2↑
När det löses i vatten är det joniserat:
PB (nej3)2 + H2O → PB2+ + 2 Nej3-
Erhållande
Det kan framställas genom att reagera metallledare, blymonoxid (PBO) eller blykarbonat3 Med salpetersyra. Det är bekvämt att använda surt överskott för att förhindra grundläggande nitrater.
PBO + 2 HNO3 (koncentrerad) → PB (nej3)2↓+ h2ANTINGEN
Ansökningar
I organisk
Dess oxidationskapacitet har tillämpning vid framställning av olika föreningar.
Det har använts för att syntetisera kalixarenos, som är organiska föreningar vars molekyl har formen på en korg som gör det möjligt att hysa andra ämnen beroende på den användning som kommer att ges till den.
Det tjänar till att få isotiocianater (R-CS) från aminer (R-NH2).
Det används i industriell skala för att förbereda bensaldehyd oxiderande benchilo -klorid. Det fungerar också som en katalysator för förestring av organiska föreningar, till exempel för att få polyestrar.
I kemisk analys
Det används som ett reagens i bestämningen av aluminium och bly i mineraler och stenar.
I färgningen av textilfibrer
Vissa kromfärgämnen kräver användning av PB (nej3)2 för att uppnå. Till exempel för att färga bomullsgult är det täckt med blynitrat och behandlas med natriumsulfat för att producera blysulfat.
Kan tjäna dig: motsvarande viktSedan appliceras en utspädd lösning av natriumdikromat för att bilda blymromat (PBCRO4) Det är ett gult pigment.
 För en tid sedan färgades gula tyger med pigment vars utgångspunkt var PB (nej3)2. Detta görs inte genom att leda toxicitet. Författare: 3D -animationsproduktionsföretag. Källa: Pixabay.
För en tid sedan färgades gula tyger med pigment vars utgångspunkt var PB (nej3)2. Detta görs inte genom att leda toxicitet. Författare: 3D -animationsproduktionsföretag. Källa: Pixabay. Idag har emellertid blypigmenten för deras toxicitet stoppats.
Det fungerar också som en mordant för att fixa färgämnena under färg eller utskrift av andra typer av fiber.
I Medina Veterinary
Det användes tidigare som kaustiskt medel vid behandling av chancros eller gangrenas hos hästar.
I metallbranschen
Blynitrat används vid elektrolytisk raffinering av bly, som ett medel för att gynna flotationen vid avlägsnande av titan för vissa leror, gör det möjligt att återvinna ädelmetaller av cyanidlösningar och används i PBO -elektroden2 vid nickelanoder.
I solceller
Det har använts i form av vattenlösning för att göra solceller baserat på Perovskita, ett titanoxidmineral.
Det syntetiserade materialet är en organometallisk eller pervskita av blyjodid som har fångat forskarnas uppmärksamhet, eftersom det har en hög ljusabsorptionskapacitet och en stor diffusionslängd på lastbärarna.
Dessa egenskaper gör det till en utmärkt kandidat för fotovoltaiska enheter, det vill säga de blir ljus till elektrisk ström.
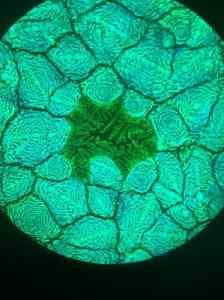 Mikrofotografi av strukturen för unavskita av blyhalogenid taget med fluorescensmikroskop. Furava/cc av (https: // creativecommons.Org/licenser/av/4.0). Källa: Wikimedia Commons.
Mikrofotografi av strukturen för unavskita av blyhalogenid taget med fluorescensmikroskop. Furava/cc av (https: // creativecommons.Org/licenser/av/4.0). Källa: Wikimedia Commons. Andra appar
Han (pbno3)2 Det har också använts:
- Vid tillverkning av matcher, vissa sprängämnen och pyrotekniska material,
- I fotografering som ett sensibiliserande medel för att täcka papperet i fototermografi,
- Inom textilindustrin för att förbättra rayon och stabilisera nylon,
- Vid eliminering av gnagare.
 Blynitrat har använts för att tillverka fyrverkerier eller pyrotekniskt material. Författare: Gratis-Goos. Källa: Pixabay.
Blynitrat har använts för att tillverka fyrverkerier eller pyrotekniskt material. Författare: Gratis-Goos. Källa: Pixabay. Risker
Eld och explosion
Även om det inte är en bränsleförening, om den utsätts för eld eller värme kan den explodera, generera toxiska kväveoxider.
Att vara ett starkt oxiderande medel finns det en fara att en brand genereras om den kommer i kontakt med organiska material.
För hälsan
Producerar ögonirritation, andning och matsmältningskanal. Det är giftigt genom inandning och intag. De vanligaste symtomen på förgiftning av denna förening är gastrointestinala, kolik, förstoppning och svaghet som kan bli förlamning av vissa muskler, bland andra, bland andra.
Dess intag kan också orsaka smärta, kramper, depression, koma och död.
För den naturliga miljön
Det är giftigt för vatten- och landorganismer, dessutom är deras skador ihållande och bioackumula i levande varelser, därför anses det vara ett farligt förorenande och bör inte kasseras till miljön.
Om det av misstag spillas i vatten, bör den neutraliseras med kalciumoxid (CAO), kalciumkarbonat (Caco3) eller natriumbikarbonat (NAHCO3).
Det har bekräftats att det är cancerframkallande för djur och eventuellt för människan.
Referenser
- ELLER.S. National Library of Medicine. (2019). Bly (ii) nitrat. Återhämtat sig från pubchem.Ncbi.Nlm.Nih.Gov.
- Hsih, t.OCH. et al. (2015). Effektiv POSVSKITE Solcell tillverkad med hjälp av en vattenhaltig blynitratföregångare. Chem Commun (Change). 2015 4 september; 51 (68): 13294-7. NCBI återhämtade sig.Nlm.Nih.Gov.
- Vratny, f. och Gugliotta, f. (1963). Teman nedbrytning av blynitrat. J. Inorg. Nukle. Kem., 1963, volym. 25, sid. 1129-1132. Återhämtat sig från Scientedirect.com.
- Chakraborty, J.N. (2014). Färgning med mineralfärger. I medel och praxis i ColorAction of Textiles. Återhämtat sig från Scientedirect.com.
- Kumari, h. och Atwood, J. (2017). Calixarenes i fast tillstånd. I referensmodulering inom kemi, molekylvetenskap och kemiteknik. Återhämtat sig från Scientedirect.com.
- Jeffery, s.G. och Hutchison, D. (1981). Aluminium. I kemiska metoder för berganalys (tredje upplagan). Återhämtat sig från Scientedirect.com
- Sandler, s.R. och Karo, W. (1992). Cyanater, isocyanater, tiocyanater och isotiocyanater. I källbok för avancerade organiska laboratorieberedningar. Återhämtat sig från Scientedirect.com.
- Smith, s.W.G. et al. (1969). Aromatiska halogenföreningar. I aromatisk kemi. Återhämtat sig från Scientedirect.com.
- Bomull, f. Albert och Wilkinson, Geoffrey. (1980). Avancerad oorganisk kemi. Fjärde upplagan. John Wiley & Sons.
- Bly, D.R. (redaktör) (2003). CRC Handbook of Chemistry and Physics. 85th CRC Press.
- Wikimedia Foundation (2020). Bly (ii) nitrat. Hämtas från.Wikipedia.org.
- Shinde, D.V. et al. (2017). Förbättrad efficy och stabilitet hos en vattenhaltig bly-nitratbaserad organometalllisk perovskit solcell. ACS Appl. Mater. 2017 gränssnitt, 9, 14023-14030. Återhämtat sig från pubar.ACS.org.
- « Fenoler eller fenolföreningar egenskaper, typer, applikationer
- Blyacetatstruktur, egenskaper, erhållning, användning »

