Molekylär syrestruktur, egenskaper, användningar
- 3061
- 540
- Erik Eriksson
han Syre syre antingen Dioxyg, Även kallad diatomisk eller gasformigt syre, det är den vanligaste elementära formen som detta element finns på planeten jorden. Dess formel är eller2, Därför är en diatomisk och homonukleär molekyl, helt apolär.
Luften vi andas består av cirka 21% syre som molekyler eller2. Ju mer vi stiger upp minskar koncentrationerna av gas syre och ökar närvaron av ozon, eller3. Vår kropp drar nytta av o2 För att syratera dina vävnader och utföra cellulär andning.
 Utan syre berikar vår atmosfärsliv vara ett ohållbart fenomen. Källa: Pixabay.
Utan syre berikar vår atmosfärsliv vara ett ohållbart fenomen. Källa: Pixabay. O2 Han är också ansvarig för förekomsten av eld: utan honom skulle det vara nästan omöjligt att ha bränder och förbränning. Detta beror på att dess huvudsakliga egenskap är att vara ett kraftfullt oxidationsmedel, vinna elektroner eller minska en vattenmolekyl eller i oxidanjoner, eller2-.
Molekylärt syre är viktigt för otaliga aeroba processer, med applikationer inom metallurgi, medicin och avloppsrening. Denna gas är praktiskt taget synonymt med värme, andning, oxidation och å andra sidan frysta temperaturer när den har i sitt flytande tillstånd.
[TOC]
Molekylär syrestruktur
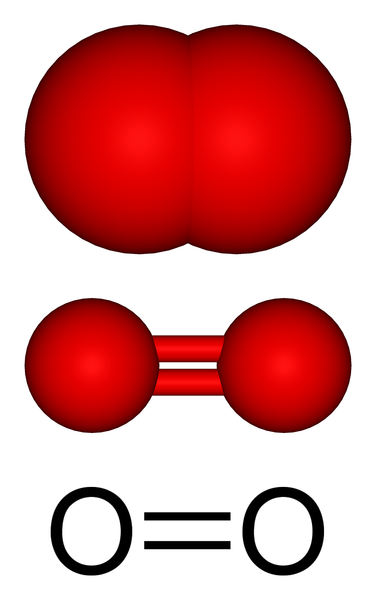
 Gasformad syremolekylstruktur. Källa: Benjah-Bmm27 via Wikipedia.
Gasformad syremolekylstruktur. Källa: Benjah-Bmm27 via Wikipedia. I den övre bilden har vi molekylstrukturen i gasformigt syre representerat med flera modeller. I de två sista bevisas egenskaperna hos den kovalenta bindningen som håller syreatomerna: en dubbelbindning O = O, där varje syreatom slutför sin oktett av Valencia.
Kan tjäna dig: diasteromererMolekylen eller2 Det är linjärt, homonukleärt och symmetriskt. Dess dubbelbindning har en längd på 121 pm. Detta korta avstånd gör en viss betydande energi som krävs (498 kJ/mol) för att bryta länken o = o, och är därför en relativt stabil molekyl.
Om så är fallet skulle atmosfärens syre ha helt försämrats över tid, eller så skulle luften ta eld på ingenting.
Egenskaper
Fysiskt utseende
Molekylärt syre är en färglös, smaklös och luktfri gas, men när man kondenserar och kristalliserar förvärvar blåaktiga toner.
Molmassa
32 g/mol (rundat värde)
Smältpunkt
-218 ºC
Kokpunkt
-183
Löslighet
Molekylärt syre är inte särskilt lösligt i vatten, men tillräckligt för att stödja marin fauna. Om din löslighet var större skulle det vara mindre troligt att dö av drunkning. Å andra sidan är dess löslighet mycket större i oljor och apolära vätskor, att kunna långsamt oxidera dem och därmed påverka deras ursprungliga egenskaper.
Energitillstånd
Molekylärt syre är ett ämne som inte kan beskrivas helt av Valencia Link Theory (TEV).
Den elektroniska syrekonfigurationen är som följer:
[Han] 2s² 2p⁴
Den har ett par saknade elektroner (eller :). När två syreatomer hittas, är de kopplade till att bilda en dubbelbindning o = O, och slutför både Octet of Valencia.
Därför molekylen eller2 Det ska vara diamagnetiskt, med alla dess parade elektroner. Det är emellertid en paramagnetisk molekyl, och detta förklaras av diagrammet över dess molekylära orbitaler:
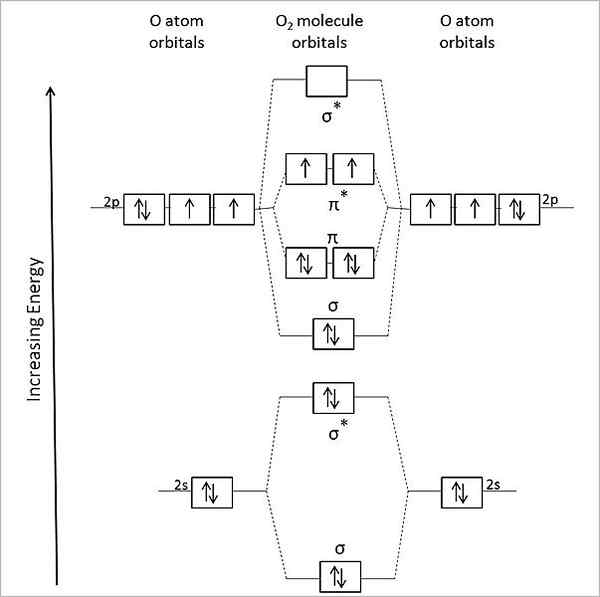 Molekylärt orbitaldiagram för gas syre. Källa: Anthony.Sebastian/CC BY-SA (https: // Creativecommons.Org/licenser/BY-SA/3.0)
Molekylärt orbitaldiagram för gas syre. Källa: Anthony.Sebastian/CC BY-SA (https: // Creativecommons.Org/licenser/BY-SA/3.0) Således beskriver den molekylära orbitalteorin (TOM) bättre eller2. De två saknade elektronerna finns i molekylära orbitaler π*, av större energi och ge syre med sin paramagnetiska karaktär.
Kan tjäna dig: metylamin: struktur, egenskaper, produktion, användningarI själva verket motsvarar detta energitillstånd triplett syre, 3ANTINGEN2, Den mest dominerande av alla. Det andra energitillståndet i syre, mindre rikligt på jorden, är singeln, 1ANTINGEN2.
Omvandling
Molekylärt syre är betydligt stabilt så länge det inte är i kontakt med något ämne som är mottagligt för oxidation, mycket mindre om det inte finns någon nära källa till intensiv värme, som en gnista. Detta beror på att o2 Det har en hög tendens att minska, få elektroner från andra atomer eller molekyler.
När den reduceras kan den skapa ett brett spektrum av länkar och former. Om det bildar kovalenta bindningar kommer det att göra det med mindre elektronegativa atomer än honom, inklusive väte, för att komma från vatten, H-O-H. Det kan också vara kol universum, för att orsaka C-O-bindningar och flera typer av syresatta organiska molekyler (Éteres, ketoner, aldehyder, etc.).
O2 Du kan också få elektroner för att omvandla i peroxider och superoxider, eller22- Jag2-, respektive. När det blir peroxid inom organismen erhålls väteperoxid, h2ANTINGEN2, H-O-O-H, en skadlig förening som bearbetas av verkan av specifika enzymer (peroxidaser och katalor).
Å andra sidan, och inte minst, o2 reagerar med oorganiskt material för att bli oxidjon, eller2-, Komponera en oändlig lista över mineralogiska massor som sväller barken och landmanteln.
Ansökningar
Svetsar och förbränning
 Syre används för att förbränna acetylen och avfyra en låga av intensiv värme som är värdefull i svetsar. Källa: Sheila/CC av (https: // CreativeCommons.Org/licenser/av/2.0)
Syre används för att förbränna acetylen och avfyra en låga av intensiv värme som är värdefull i svetsar. Källa: Sheila/CC av (https: // CreativeCommons.Org/licenser/av/2.0) Syre används för att genomföra förbränningsreaktionen, genom vilken ett ämne exotermiskt ger av eld. Denna eld och dess temperatur varierar beroende på ämnet som brinner. Således kan mycket heta lågor erhållas, såsom acetylen (ovan), med vilka metaller och legeringar svetsas.
Kan tjäna dig: entalpiOm inte för syre, kunde bränslen inte bränna och ge all sin kalorinergi, brukade ta av raketer eller starta bilar.
Oxidantmedel i grön kemi
Tack vare denna gas syntetiseras eller produceras en oändlig organiska och oorganiska oxider. Dessa reaktioner är baserade på den oxiderande kraften hos molekylärt syre, som också är en av de mest livskraftiga reagensen i grön kemi för att få farmaceutiska produkter.
Assisterad andning och avloppsrening
Syre är avgörande för att möta andningsbehov hos patienter med allvarliga hälsotillstånd, i dykare när de går ner på låga djup och i bergsklättrare, i vars höjder syrekoncentrationen ser dramatiskt reducerad.
På samma sätt matar "syre" aeroba bakterier, som hjälper till att försämra förorenande avfall från avloppsvatten, eller hjälper till att andas fisk, i vattenhaltiga grödor för skydd eller handel.
Referenser
- Shiver & Atkins. (2008). Oorganisk kemi. (fjärde upplagan). MC Graw Hill.
- Wikipedia. (2020). Syre av syre. Hämtad från: i.Wikipedia.org
- Hone, c.TILL., Kappe, c.ANTINGEN. (2019). Användning av molekylärt syre för aeroba oxidationer av vätska i kontinuerligt flöde. Topp Curr Chem (Z)377, 2. doi.org/10.1007/s41061-018-0226-z
- Kevin Beck. (28 januari 2020). 10 användningar för syre. Återhämtat sig från: forskning.com
- Kliffsnoter. (2020). Biokemi I: Kemin för molekylärt syre. Återhämtat sig från: cliffsnotes.com
- GZ Industrial Supplies. (2020). Industriella fördelar med syrgasgas. Hämtad från: GZ-supplies.com
- « Kultur av portugals traditioner, seder, gastronomi, religion
- Destruktiv formel och ekvationer, exempel, träning, träning »

