Pyridinstruktur, egenskaper, användningar, toxicitet, syntes
- 3075
- 584
- Anders Larsson
De Pyridin Det är en aromatisk amin vars kemiska formel är c5H5N. Det är kväveversionen av Benzene, eftersom en grupp -Ch = har ersatts av en kväveatom (N). Tillsammans med pyrolen bildar pyridin gruppen av enklare aromatiska aminer av alla.
Ursprungligen inträffade pyridinet från Hulla Tar, men det var en liten prestationsmetod. Detta ledde till skapandet av flera metoder för dess kemiska syntes, vilket rådde den där reaktionen av formaldehyden, acetaldehyd och ammoniak används.
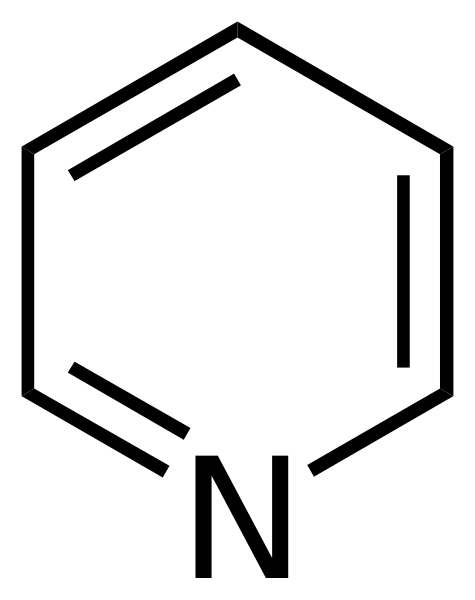 Strukturell formel av pyridin. Källa: Calvero. / Allmängods
Strukturell formel av pyridin. Källa: Calvero. / Allmängods Pyridinet erhölls för första gången av Thomas Anderson (1843), en kemist Escosses, som genom uppvärmning av djurkött och ben producerade en olja från vilken pyridinet renades.
 Thomas Anderson (juli 1819)
Thomas Anderson (juli 1819) Pyridin används som råmaterial för syntes av föreningar som eliminerar och kontrollerar spridningen av insekter, svampar, örter etc. Det används också i utarbetandet av många mediciner och vitaminer, förutom att de används som lösningsmedel.
Pyridin är en toxisk förening som på kroniskt sätt skada på levern, njurarna och det centrala nervsystemets funktion. Pyridin kan komma in i kroppen på grund av intag, inandning och spridning genom huden. Det är känt i kemikalien eftersom det är ett ämne som kan orsaka hjälplöshet hos män.
[TOC]
Pyridinstruktur
Molekyl
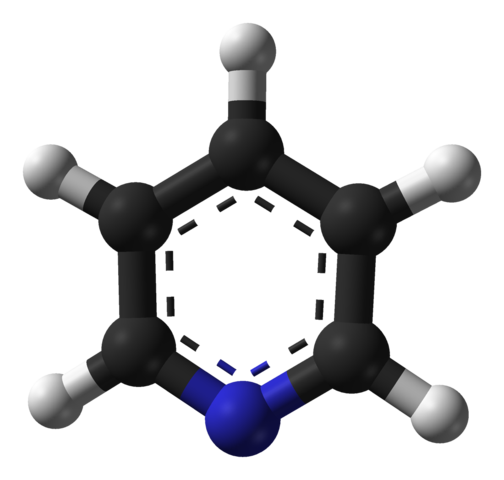 Molekylstruktur av pyridin. Källa: Benjah-Bmm27 / Public Domain
Molekylstruktur av pyridin. Källa: Benjah-Bmm27 / Public Domain Den överlägsna bilden visar molekylstrukturen hos pyridinet representerat av en modell av sfärer och staplar. Som man kan se är dess molekyl mycket lik den hos bensen, med den enda skillnaden att den har en av sina kol (svarta sfärer) ersatt av kväve (blå sfär).
Kväve, eftersom det är mer elektronegativt, lockar elektronisk densitet mot sig själv, vilket skapar ett permanent dipolmoment i pyridin. Därför interagerar pyridinmolekyler genom dipol-dipolokrafter.
Väteatomer är de fattigaste regionerna i elektroner, så att de kommer att vara orienterade i riktning mot kväveatomen hos en angränsande molekyl.
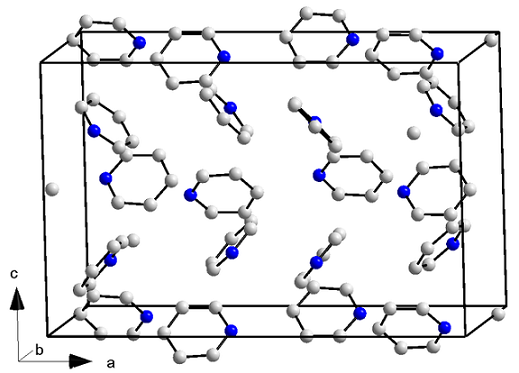
Kristall-
 Kristallin struktur av pyridin. Källa: orci/cc by-s (https: // creativecommons.Org/licenser/BY-SA/3.0)
Kristallin struktur av pyridin. Källa: orci/cc by-s (https: // creativecommons.Org/licenser/BY-SA/3.0) Pyridinmolekyler har inte bara dipol-dipolo-krafter, utan också med interaktioner mellan aromatiska ringar. Således lyckas dessa molekyler placera sig i ordnad för att orsaka en ortorrombisk strukturkristall (övre bild) vid en temperatur av -41,6 ° C.
Pyridinegenskaper
 Pyridinprov. LHCHEM/CC BY-SA (https: // Creativecommons.Org/licenser/BY-SA/3.0)
Pyridinprov. LHCHEM/CC BY-SA (https: // Creativecommons.Org/licenser/BY-SA/3.0) Fysiskt utseende
Färglös vätska, med en genomträngande lukt, liknande den för fisk.
Kan tjäna dig: redoxbalansmetod: steg, exempel, övningarMolmassa
79.1 g/mol
Densitet
0,9819 g/ml
Smältpunkt
-41,6 ºC
Kokpunkt
115.2 ºC
Löslighet
Det är blandat med vatten, och även med alkohol, eter, oljeeter, oljor och många organiska vätskor i allmänhet.
Ångtryck
16 mmHg vid 20 ºC.
Ång-densitet
2,72 i förhållande till vatten = 1
Brytningsindex (nD)
1 5093
Gegga
0,88 cp
Dipolärt ögonblick
2.2 D
antändningspunkt
21 ºC
Självriktningstemperatur
482 ºC
Sönderfall
När den värms upp till sönderdelning avger en cyanidrök.
Korrosion
Pyridin i flytande form attackerar vissa former av plast, gummi och beläggningar.
pH
8.5 (0,2 m lösning i vatten)
Basicitet och reaktivitet
Pyridin är en svag bas. Det är en tertiär amin vars 0,2 M -lösning i vatten producerar ett pH på 8,5. Den har liten affinitet för elektroner på grund av kvävelektronegativitet, så deras kol, lider vanligtvis inte en elektrofil substitution.
Pyridinupplevelser nukleofil substitution, helst i positioner C4 och C2 Från ringen. På grund av dess förmåga att donera elektroner är pyridinet mer oxidation mer än bensen och reagerar våldsamt med svavelsyra, salpetersyra och anhydrid maleico.
Användning av pyridin
Bekämpningsmedel
Pyridin är en föregångare för föregångare och Diquat Herbicid. På samma sätt tjänar det för syntesen av klorpirifos insekticid, vars första steg är klorering av pyridin. Det är också det ursprungliga råmaterialet att få fungiciden baserat på pyritionen.
Lösningsmedel
Pyridin är ett polärt lösningsmedel, används för återförsäljarreaktioner och antibiotikaktraktion. Pyridin används som lösningsmedel inom färg- och gummiindustrin, och även i forskningslaboratorier som lösningsmedel i extraktionen av växthormoner.
Medicin
Pyridin fungerar som en initial punkt i syntesen av cetilpyridinium och laurilpyridinium, föreningar som används som antiseptika i orala och tandvårdsprodukter. Pyridinmolekylen är en del av den kemiska strukturen för många mediciner.
Till exempel esmeprazol, som används vid behandling av gastroesofageal återflöde. Loratidin är en annan medicin som framställs baserat på pyridin, känd som Claritin, som används som en behandling av allergiska processer.
Pyridin (fenazopyridin) tabletter används vid symptomatisk behandling av en irritation av urinvägarna, som i vissa fall åtföljs av smärta, brinnande och brådskande urinering. Fenazopyridin är ett färgämne som uppfyller en smärtstillande funktion i urinvägarna.
Di-acylhidrazin är ett pyridinderivat som har en antibakteriell aktivitet som utövar på Gram-negativa bakterier, till exempel OCH. coli, och gram positiva bakterier, till exempel S. Albus.
Pyridin fungerar som grund för tiazolo [5,4-6] pyridin, bestående av antiviral aktivitet, särskilt mot p-massviruset av influensa. 2-acetylpyridinet, ett pyridinderivat, har stor antitumoraktivitet och är en leukemi-hämmare.
Kan tjäna dig: Mercury Oxide (HG2O)Andra
Pyridin används vid tillverkning av vitaminer, gummiprodukter, lim, målningar och insekticider. Det används också i denaturering av alkohol och i färgningen av vissa textilier.
20 % av pyridinet används vid beredning av piperidin. Piperidin ingriper i vulkanisering och jordbruk.
Pyridin används också i syntesen av polykarbonerade hartser, som en matsmak och som ett reagens för cyaniddetektering.
Giftighet
- Pyridin kommer in i organismen främst på grund av inandning och diffusion genom huden. Akut exponering för pyridin kan ge irritation och brännskador i ögonen och huden.
- Pyridin kan komma från dermatit och allergi i huden. Utvecklingen av allergi kan åtföljas utöver klåda och utslag.
- Pyridininandning kan orsaka näsa och irritation i halsen, åtföljd av hosta och en astmatisk andningsandring.
- Genom intag kan pyridin orsaka illamående, kräkningar, diarré och buksmärta. På samma sätt kan införlivandet av en hög dos av pyridin i organismen orsaka: huvudvärk, trötthet, blekning, fantastisk, yrsel, förvirring och så småningom äta och död.
- De organ som är mest drabbade av pyridinens verkan är levern, njurarna, de manliga könsorganen och centrala nervsystemet. Det kan också verka på benmärg, vilket inducerar produktion av blodplättar. En cancerframkallande verkan av pyridin har inte bevisats hos djur.
OSHA etablerade en exponering i luften på 5 ppm per 8 -timmars arbetsdag.
Syntes
De första metoderna för att erhålla pyridin baserades på dess extraktion av organiska material. Thomas Anderson (1843) erhöll för första gången pyridin genom att värma kött och djurben. I ett första steg producerade Anderson en olja från vilken han lyckades destillera pyridin.
Traditionellt erhölls pyridin från Hulla Tar eller kolförgasning. Dessa procedurer var besvärliga och av liten prestanda, eftersom koncentrationen av pyridin i dessa råvaror var mycket låg. En syntesmetod var nödvändig.
Chichibabinmetod
Även om det finns många metoder för pyridinsyntes, används fortfarande Chichibabin -proceduren 1923 främst. I denna metod syntetiseras pyridinet från reaktionen av formaldehyd, acetaldehyd och ammoniak, som är billiga reagens.
Kan tjäna dig: typ av länk på 02I det första steget reagerar formaldehyd och acetaldehyd för att bilda akroleinföreningen, i en kondensationsreaktion av Knoevegel, som också bildar vatten.
 Pyridinkondensation från akroleína och acetaldehyd
Pyridinkondensation från akroleína och acetaldehyd Slutligen, i ett andra steg, reagerar Acroleína med formaldehyd och ammoniak för att bilda dihydropyridin. Därefter oxideras dihydropyridin till pyridin i en reaktion vid 350 -550 ° C i närvaro av en fast katalysator, till exempel kiseldioxid -alumina.
Reaktioner
Elektrofylsubstitutioner
Dessa substitutioner förekommer vanligtvis inte på grund av låg elektronisk pyridintäthet.
Sulfanation ger större svårigheter än nitrering. Men bromation och klorering inträffar lättare.
Pyridin-n-oxid
Oxidationsstället i pyridinet är kväveatomen, som är oxidationen som produceras av persikorna (syror som har en OOH -grupp). Kväveoxidation främjar elektrofil substitution i kol 2 och 4 av pyridin.
Nukleofilsubstitutioner
Pyridin kan uppleva flera nukleofila substitutioner på grund av den låga elektroniska densiteten hos pyridinringen kol. Dessa substitutioner förekommer lättare i pyridinmolekylen modifierad av brom, klor, fluor eller sulfonsyra.
Föreningarna som utförs av nukleofila attacker på pyridin är vanligtvis: alkoxider, tyolater, aminer och ammoniak.
Radikala reaktioner
Pyridin kan dimerreras av radikala reaktioner. Radikal pyridindimerisering utförs med elementärt natrium eller nickel raney, att kunna producera 4,4'-Bipperidine eller 2.2'-Bipperidine.
Reaktion på kväveatom
Syror, enligt Lewis, läggs lätt till kväveatomen i pyridin och bildar pyridinsalter. Pyridin är en Lewis -bas som donerar ett par elektroner.
Hydrogenering och reduktionsreaktion
Piperidin produceras genom hydrering av pyridin med nickel, kobolt eller rutenium. Denna reaktion görs vid höga temperaturer åtföljd av användningen av en katalysator.
Referenser
- Graham solomons t.W., Craig b. Fryhle. (2011). Organisk kemi. (10th Utgåva.). Wiley Plus.
- Carey f. (2008). Organisk kemi. (Sjätte upplagan). MC Graw Hill.
- Morrison och Boyd. (1987). Organisk kemi. (Femte upplagan). Addison-Wesley Iberoamericana.
- Wikipedia. (2020). Pyridin. Hämtad från: i.Wikipedia.org
- Nationellt centrum för bioteknikinformation. (2020). Pyridin. Pubchemdatabas., CID = 1049. Återhämtat sig från: pubchem.Ncbi.Nlm.Nih.Gov
- Laura Foist. (2020). Pyridin: Struktur, formel och fysiska egenskaper. Studie. Återhämtat sig från: studie.com
- Atof Ali Altaf, Adnan Shahzad, Zarif Gul, Nasir Rasool, Amin Badshah, Bhajan Lal, Ezzat Khan. (2015). En översyn av den medicinska betydelsen av pyridinderivat. Journal of Drug Design and Medicinal Chemistry. Vul. 1, nej. 1, sid. 1-11. Doi: 10.11648/j.Jddmc.20150101.elva
- WebMD. (2020). Pyridintavla. Hämtad från: WebMD.com
- New Jersey Department of Health and Senior Services. (2002). Pyridin. [Pdf]. Återhämtat sig från: nj.Gov
- « C ++ historia, egenskaper, datatyper, exempel
- Väsentliga fettsyror Funktioner, betydelse, nomenklatur, exempel »

