Isokorisk process
- 717
- 134
- Johan Eriksson
Vad är en isokorisk process?
En Isokorisk process Det är alla termodynamiska processer där volymen förblir konstant. Dessa processer får ofta också namnet på isometriska eller isovolumetriska. I allmänhet kan en termodynamisk process uppstå vid konstant tryck och kallas sedan isobarisk.
När det inträffar vid konstant temperatur sägs det i så fall att det är en isotermisk process. Om det inte finns något värmeväxling mellan systemet och miljön, är det tal om adiabatic. Å andra sidan, när det finns en konstant volym, kallas processen isokorisk.

När det gäller den isokoriska processen kan det bekräftas att i dessa processer är tryckvolymarbetet ogiltigt, eftersom detta är resultatet av att multiplicera trycket med volymökningen.
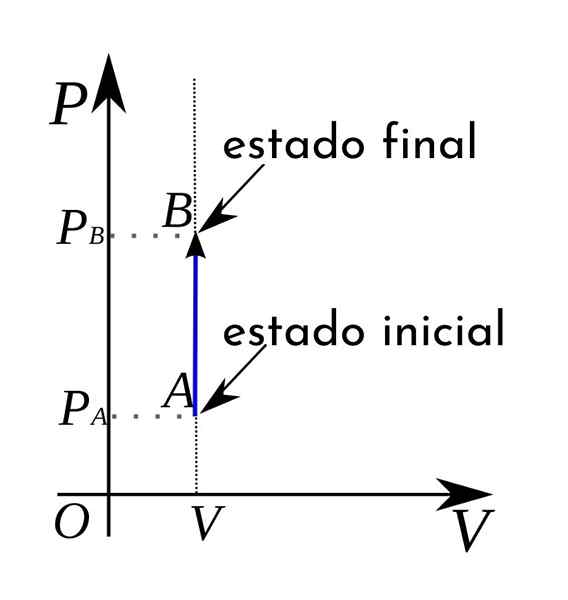
I ett termodynamiskt tryckvolymdiagram representeras dessutom isokoriska processer i form av en vertikal rak linje.
Formler och beräkning
Den första principen för termodynamik
I termodynamik beräknas arbetet utifrån följande uttryck:
W = p ∙ ∆ v
I detta uttryck är W arbetet uppmätt i Joules, P -trycket uppmätt i Newton per kvadratmeter, och ∆ V är variationen eller ökningen i volym uppmätt i kubikmeter.
På samma sätt konstaterar den första principen för termodynamik att:
∆ u = q - w
I denna formel är det det arbete som görs av systemet eller på systemet, som är värmen som tas emot eller utfärdas av systemet, och ∆ u Det är systemets interna energisvariation. Vid detta tillfälle mäts de tre storlekarna i Joules.
Eftersom arbetet i en isokorisk process är noll, visar det sig att det är uppfyllt att:
Kan tjäna dig: Neptune (Planet)∆ u = qV (sedan, ∆ v = 0, och därför w = 0)
Det vill säga att systemets inre energivariation endast beror på värmeutbyte mellan systemet och miljön. I detta fall kallas den överförda värmen värme till konstant volym.
 Värmekapacitet i konstant volym
Värmekapacitet i konstant volym
Värmekapaciteten för en kropp eller system är resultatet av att dela mängden energi i form av värme som överförs till en kropp eller ett system i en given process och temperaturförändringen som upplevs av samma.
När processen utförs med konstant volym talas den om värmekapacitet till konstant volym och betecknas med Cv (molär värmekapacitet).
Det kommer att uppfyllas i så fall:
Qv = N ∙ cv ∙ ∆t
I denna situation är n antalet mol, cv Det är den ovannämnda värmekapaciteten molär till konstant volym och ∆t är temperaturökningen som kroppen eller systemet upplever.
Dagliga exempel på isokoriska processer
Det är lätt att föreställa sig en isokorisk process, det är bara nödvändigt att tänka på en process som inträffar i konstant volym; det vill säga där behållaren som innehåller materialet eller materialet inte ändrar volym.
Ett exempel kan vara fallet (ideal) inlåst i en stängd behållare vars volym inte kan ändras på något sätt som tillförs värme. Anta fallet med en gas låst i en flaska.
Genom att överföra värme till gas, som redan förklarats, kommer det att resultera i en ökning eller ökning av dess inre energi.
Den omvända processen skulle vara en gas innesluten i en behållare vars volym inte kan modifieras. Om gasen svalnar och ger värme till miljön, skulle gastrycket och värdet på den inre energin i gasen minska skulle minskas.
Det kan tjäna dig: diskret variabel: egenskaper och exempelDen perfekta cykeln otto
Otto -cykeln är ett idealiskt fall av den cykel som används av bensinmaskiner. Emellertid var dess första användning i maskinerna som använde naturgas eller andra bränslen i ett gasformigt tillstånd.
I vilket fall som helst är Ottos ideala cykel ett intressant exempel på den isokoriska processen. Det inträffar när förbränningen av bensin- och luftblandningen i en förbränning av bensin och luftblandning sker omedelbart.
I så fall sker en ökning av temperaturen och gastrycket i cylindern och förblir den ständiga volymen.
Praktiska exempel
Första exemplet
Med tanke på en gas (ideal) låst i en cylinder försedd med en kolv, ange om följande fall är exempel på isokoriska processer.
- Ett 500 J -arbete på gas görs.
I det här fallet skulle det inte vara en isokorisk process för att göra ett jobb på bensin är det nödvändigt att komprimera det, och därför ändra dess volym.
- Gasen expanderar horisontellt kolven.
Återigen skulle det inte vara en isokorisk process, eftersom gasutvidgning innebär en variation i dess volym.
- Cylinderkolven är fixerad så att gas inte kan flyttas och gasen kyls.
Vid detta tillfälle skulle det vara en isokorisk process, eftersom det inte skulle finnas någon volymvariation.
Andra exempel
Bestäm variationen av inre energi som kommer att uppleva en gas som finns i en behållare med en volym av 10 L som skickas till 1 atm tryck, om temperaturen stiger från 34 ºC till 60 ° C i en isokorisk process, känd dess specifika värmelätt värme värme Cv = 2.5 ·R (varelse R = 8.31 j/mol · k).
Det kan tjäna dig: Graff Van Generator: Fester, hur det fungerar, applikationerEftersom det är en konstant volymprocess kommer den interna energimärgen endast att inträffa till följd av värmen som levereras till gas. Detta bestäms med följande formel:
Qv = N ∙ cv ∙ ∆t
För att beräkna den levererade värmen är det först nödvändigt att beräkna molen med gas som finns i behållaren. För detta är det nödvändigt att ta till ekvationen av idealiska gaser:
P ∙ V = N ∙ R ∙ T
I denna ekvation är n antalet mol, r är en konstant vars värde är 8,31 j/mol · k, t är temperaturen, p är trycket som gasen uppmätt i atmosfärer och t utsätts och t är temperaturen uppmätt i Kelvin.
Det rensas och erhålls:
n = r ∙ t/ (p ∙ V) = 0, 39 mol
Så att:
∆ u = qV = N ∙ cv ∙ ∆t = 0,39 ∙ 2,5 ∙ 8,31 ∙ 26 = 210,65 J

