Oxidas Test Foundation, procedur och användning
- 1908
- 491
- Johan Eriksson
De oxidastest Det är en diagnostisk metod som visar närvaron av det enzymatiska komplexet som kallas cytokromoxidas C. Detta system inducerar omvandlingen av den reducerade till oxiderad cytokrom, eftersom det fångar syre och detta i sin tur fungerar som den sista elektronacceptorn (h+) I andningskedjan.
Oxidastermen är ett sammanfattande sätt att hänvisa till cytokromoxidasenzymet, även känt som oxidasindefenol. I forntida tider trodde man att cytokromoxidas och inophenoloxidasenzymer var två olika enzymer, men idag är det känt att de är samma.
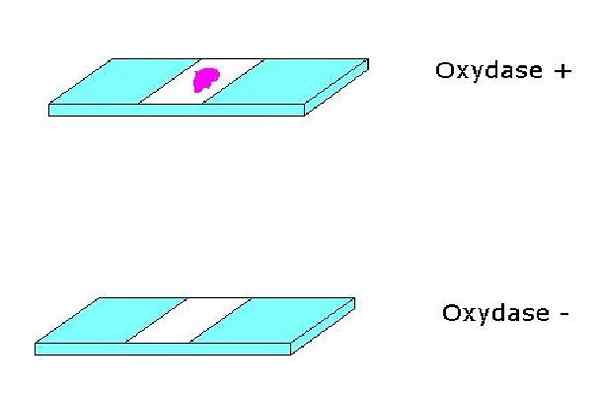
 Positivt och negativt oxidastest. Källa: Ingen maskinläsbar författare tillhandahållen. Alfa.Prim ~ Commonswiki antas (baserat på upphovsrättsanspråk). [Allmängods]
Positivt och negativt oxidastest. Källa: Ingen maskinläsbar författare tillhandahållen. Alfa.Prim ~ Commonswiki antas (baserat på upphovsrättsanspråk). [Allmängods] För sin del är cytokromer hemoproteiner som innehåller järn och kompletterar cytokromoxidas -systemet. Cytokromer kan variera från en art till en annan.
Det finns olika sorter av cytokromer (cytokromer A1, A2, A3 och 0). Vissa bakterier kan bara producera en, men andra upp till två eller tre samtidigt. I detta avseende är närvaron av cytokrom A och A3 känd som cytokrom - oxidas C. Detta är den typ av cytokrom som upptäcker oxidastestet.
Genrerna Neisseria och Pseudomonas innehåller oxidas C -cytokrom. Dessa genrer ger det positiva oxidastestet, vilket hjälper till att skilja dem från Acinetobacter och Stenotrophomonas genrer respektive.
Det finns också andra genrer som är positiva oxidas.
[TOC]
Grund
Egenskaper för cytokromoxidasystemet c
Oxidascychocroma -systemet C verkar på följande sätt: Positiva oxidasmikroorganismer använder syre för att generera energi genom aerob andning. Detta system fungerar tack vare transport av elektroner från givarämnen som NADH+ Mot att ta emot ämnen, i detta fall syre.
Detta resulterar i energi (ATP) och vattenperoxid, beroende på cytokromsystemet oxidas som har mikroorganismen.
Det är därför de mest positiva oxidasbakterierna också är positiva katalas, ett nödvändigt tillstånd för att eliminera väteperoxid som produceras, eftersom detta ämne är giftigt för bakterier.
Oxidas C -cytokromsystemet finns i vissa aeroba bakterier, vissa valfria anaeroba, knappa mikroaerofil och ingen strikt anaerob. Det senare är förståeligt, eftersom strikta anaerober inte kan leva i närvaro av syre, därför saknar de cytokromoxidas -systemet.
Bevisprincip
I detta test använder du ämnen som fungerar som konstgjorda elektronacceptorer och ersätter de infödda inom elektrontransportkedjan.
Huvudsakligen färgämnen såsom parafenylendiamin och indofenol används, som fungerar som receptorsubstrat och konstgjorda elektrondonatorer.
Parafenyndiamin oxideras av cytokromoxidas C -systemet. Färgen i sin reducerade form är färglöst, men i sin oxiderade form är det färgat.
Detta är så närvaron av cytokromoxidas C -systemet C; Tja, en positiv reaktion kommer att generera en lavendel- eller blå färg -Púrpura beroende på det använda reagenset.
Kan tjäna dig: paleobiologi: historia, specialiteter, upptäckterÅ andra sidan, om det sista elektronacceptorämnet i andningskedjan skiljer sig från syre, kommer oxidastestet att ge negativt (det finns ingen färgproduktion); Detta är fallet med anaeroba mikroorganismer.
På samma sätt, om den cytokrom som används av mikroorganismen skiljer sig från cytokromoxidas C, kommer det också att ge det negativa testet.
Procedur
För oxidastestet finns det flera reagens och protokoll, alla med samma syfte.
Reagens
Kovacs Reactive, Gordon och McLeod Reagent, Nadi Reagent, Carpenter Reagent, Suhrland och Morrison, och användning av oxidasskivor.
-Kovacs oxidasreagens
Den består av tetrametyl-p-fenylendiamindiklorhydrat vid 1%.
Kovacs -reagenset framställs genom att lösa 1 gr av ämnet som nämns i 50 ml destillerat vatten. Det är subtilt uppvärmt tills dess totala lösning. Överför till en bärnstensflaska tillräcklig kapacitet och slutför volymen vid 100 ml med destillerat vatten. Vänta minst 15 minuter innan du använder. Spara i kylen skyddad från ljus.
Det roteras som ett Kovacs -oxidasreagens, för att skilja det från Kovacs -reagenset som används för att avslöja Indol -testet. Detta reagens är det mest känsliga, mindre giftiga men dyrare än resten av reagensen.
En positiv reaktion kommer att vara bevis. En negativ reaktion bevisas eftersom det inte finns någon färgförändring i kolonin eller det tar en lätt rosa färg. Mediet kan också mörkna, men det betyder inte positiv reaktion.
Med detta reagens är reaktionstiden avgörande, den färgförändringen som inträffar mellan 5 till 15 sekunder betraktas som en positiv reaktion.
-Gordon och McLeod Reagent
Det består av dimetyl-P-fenylendiamindiklorhydrat, även känd som N-dimetyl-P-fenylendiamin eller P-amynodimetylanilin P-amokorhydrat. Det är beredd såsom beskrivs för Kovacs -oxidasreagenset och ersätter ämnet involverat.
Detta reagens är något mer stabilt än Kovacs-oxidasreagenset, även om alla reagens som innehåller p-penilendiamine är instabila.
Denna reaktion är sen.
-Nadi -reagens
Den består av 1% a-naftol i etylalkohol (95% etanol) och 1% amin-limanylin. Blandningen framställs i lika stora delar och använder absolut etylalkohol som en flyt, tills den tillräckliga mängden är klar för 100 ml.
-Carpenter Reactive, Suhrland och Morrison
Den består av 1% p-amynodimetylalaninoxalat. Förbered dig på samma sätt till det som beskrivs för Kovacs oxidasreagens och ändras för motsvarande ämne.
Kan tjäna dig: Food Chain of the JungleMed lösningen klar framställs reaktiva remsor enligt följande: Whatman 6-8 cm nummer 1.
De får torka utan att ha kontakt med metall, spara i burktråden med torkmedel och hålla i kylskåp. Dessa remsor är stabila i upp till 6 månader.
Det är det mest stabila reagenset av alla nämnda, att kunna hålla i lösning upp till 6 månader. En annan punkt till förmån är att mediet inte färgar runt kolonin, om det används direkt på plattan.
Utseendet på en röd färg tolkas som ett positivt test.
-Oxidasskivor
De är kommersiella skivor som är impregnerade med reagens för oxidastest. Det finns flera kommersiella varumärken på marknaden.
Användningen är ganska praktisk, eftersom vi inte får förbereda färska reagens, vilket underlättar arbete. De erhållna resultaten är tillförlitliga så länge skivorna är korrekt bevarade.
Protokoll
Direktplattmetod, indirekt metod på papper och användning av impregnerade skivor med oxidasreagens.
-Direktplatta metod
2 eller 3 droppar av någon av de ovannämnda reagensen läggs till för detta ändamål direkt på kolonin (erna) i en odlingsmediumplatta som inte innehåller glukos.
Förändringen eller inte färgen på kolonierna tolkas, inte mediet. Den giltiga reaktionstiden beror på det använda reagenset.
-Indirekt metod på papper
Skär ett stycke filterpapper (Whatman N ° 1) till en storlek på 6 cm2 Och den placeras i en tom petri.
Tillsätt 2 eller 3 droppar av Kovacs -oxidasreagenset på papper, delta i kolonin som du vill studera med ett platinumhandtag eller träpinne och förlänga det i en rak linje på det impregnerade reagenspapperet. Tolka under en period av 5 till 10 sekunder.
Med remsorna förberedda med snickaren, Suhrland och Morrison Reagent sträcker sig en koloni på torrremsan. Samma remsa tjänar till att prova flera stammar. Tolk på 10 sek.
-Skivor (mdirekt etod)
Subtilt fuktar kommersiella skivor med sterilt destillerat vatten och övervinner kolonin för att studera. Det rekommenderas att använda plattorna vid 35 ° C, om plattor används vid rumstemperatur eller kylda plattor är reaktionen lite långsammare. Tolka färgförändringen mellan 10 till 20 sek.
Kolonier som finns i blod eller choklad kan användas.
-Skivor (indirekt metod)
Fukta albumet som beskrivits ovan. Placera den på en tom petri. Ta en tillräcklig mängd koloni för att studera med ett platinahandtag eller träpinne och placera på skivan. Tolka färgförändringen mellan 10 till 20 sek.
Använda sig av
Släktet Neisseria och Acinetobacter liknar ibland mycket morfologiskt eftersom även om Acinetobacter -genren är en gram negativ Bacillus, kan den ibland anta en kokoidform och distribuera i par, simulera släktet Neisseria.
Kan tjäna dig: limnologiI detta fall är oxidastestet verkligen användbart. Kön Neisseria är positiv och negativ acinetobacter.
Men släktet Moraxella är mycket lik släktet Neisseria och båda ger positiv reaktion; Det är därför vi alltid måste utföra kolhydratfermenteringstester för definitiv identifiering.
Å andra sidan är oxidastestet användbart för att differentiera en bakterie som tillhör Enterobacteriaceae -familjen (all negativ oxidas) av andra fermers, såsom pasturelgenus, aeromoner, plesiomonas (positivt oxidas) av.
Släktet Vibrio och Helicobacter är också positiva oxidas.
QA
Använd kända stammar av Escherichia coli som negativ kontroll och stammar av Pseudomonas aeruginosa Som positiv kontroll.
Begränsningar
-Reagens måste användas nyförberedda, deras livslängd i rumstemperatur är kort för att vara mycket instabil. Kyls kan pågå mellan 5 dagar till 2 veckor.
-Reagensen är färglösa, om de byter färg måste de kasseras. Skadade skivor är uppenbara eftersom de blir mörka med tiden.
-En positiv reaktion med oxidasreagenset för Kovacs mellan 15-60 sek betraktas som en försenad reaktion och efter 60 sekunder bör det betraktas som negativt.
-han Hemofylus influensa Det ger en negativ oxidasreaktion om något reagens med dimetyl-p-fenylendiamin används, men positivt om oxidasreagenset för kovacs (tetrametyl-p-fenylendiamin) används användbart) användbart) användbart).
-Media som innehåller glukos stör i testet, falskt negativt.
-Stammarna av Bordetella pertussis De kan ge falskt positiv reaktion om de kommer från mycket koncentrerade blodagarplattor.
-Användningen av metallhandtag (järn) som ger falskt positiv reaktion.
rekommendationer
-Eftersom reagensen är mycket instabila och tenderar att själv.
-Ett annat sätt att försena självuttaget av reagenset är att lägga till 0,1% askorbinsyra vid beredning av reagens.
-Eftersom reagens är instabila rekommenderas det att utföra veckokvalitetskontroll varje vecka.
-Reagens som inte klarar kvalitetskontrolltestet bör inte användas.
Referenser
- Koneman E, Allen S, Janda W, Schreckenberger P, Winn W. (2004). Mikrobiologisk diagnos. 5: e upplagan. Pan -amerikanska redaktionella.TILL. Argentina.
- Forbes B, Sahm D, Weissfeld A. (2009). Bailey & Scott mikrobiologisk diagnos. 12 ed. Pan -amerikanska redaktionella.TILL. Argentina.
- "Oxidastest." Wikipedia, fri encyklopedi. Jan 2018, 10:32 UTC. Apr 2019, 14:03
- Världshälsoorganisationen. Laboratoriehandbok för identifiering och test av mottaglighet för antimikrobier från bakterianska patogener av betydelse för folkhälsa i utvecklingsvärlden.2004. Finns på: vem.Int/drugresistens/infosharing
- Reaktiva remsor för diagnos av oxidasaktivitet i bakterier. Kubansk rev. 2000; 52 (2): 150-151.

