Keratintyper, struktur, plats och funktioner
- 5129
- 95
- Anders Larsson
De keratin Det är ett olösligt fibröst protein som är en strukturell del av cellerna och integumenten för många organismer, särskilt av ryggradsdjur. Den har mycket varierande former och är lite reaktiv, kemiskt sett.
Dess struktur beskrevs först av forskarna Linus Pauling och Robert Corey 1951, medan de analyserade djurens hårstruktur. Dessa forskare gav också indikationer om strukturen i myosin i muskelvävnad
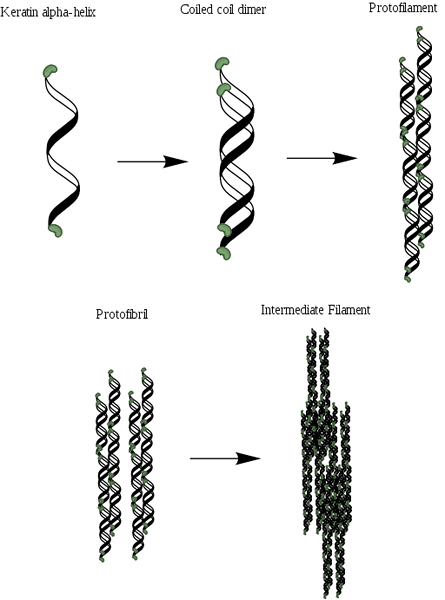
 Alfa-Queratin Organization Scheme (källa: MLPATTON [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenser/BY-SA/4.0)] via Wikimedia Commons)
Alfa-Queratin Organization Scheme (källa: MLPATTON [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenser/BY-SA/4.0)] via Wikimedia Commons) Efter kollagen är det ett av de viktigaste proteinerna hos djur och representerar det mesta av hårets torrvikt, ull, naglar, klor och hovar, fjädrar, horn och en betydande del av det yttre skiktet i huden.
De "keratiniserade" elementen av djur kan ha mycket olika morfologier som i stor utsträckning beror på den funktion de utövar i varje speciell organisme.
Keratin är ett protein som har egenskaper som ger det stor mekanisk effektivitet när det gäller spänning och komprimering. Det produceras av en speciell typ av celler som kallas "keratinocyter", som vanligtvis dör efter att de producerat det.
Vissa författare bekräftar att keratiner uttrycks i ett tyg- och scenstadion. Hos människor finns det mer än 30 kodande gener för dessa proteiner och dessa tillhör en familj som utvecklats för flera omgångar med genetisk duplicering.
[TOC]
Typer av keratiner och deras struktur
Det finns i huvudsak två typer av keratiner: α och ß. Dessa kännetecknas genom att ha en grundstruktur som främst består av polypeptidkedjor som kan registreras som alfa-propeller (a-queratinas) eller gå med i parallellt som ß-veckade ark (ß-cheap).
α-queratinas
Denna typ av keratin är den mest studerade och det är känt att däggdjur har minst 30 olika varianter av denna typ av keratin. I dessa djur är a-det en del av naglar, hår, horn, hjälmar, spikar och epidermis.
Liksom kollagen innehåller dessa proteiner i sin struktur en riklig andel av små aminosyror som glycin och alanin, som är de som möjliggör etablering av alfa -propeller. Molekylstrukturen hos en a-queratin består av tre olika regioner: (1) kristallina fibriller eller propeller, (2) filamentens terminala domäner och (3) matrisen.
Propellerna är två och bildar en dimer som liknar en spiral som förblir förenad tack vare närvaron av länkar eller disulfur broar (S-S). Var och en av propellerna har cirka 3.6 aminosyravfall i varje sväng som ger och består av mer eller mindre 310 aminosyror.
Det kan tjäna dig: Flora och fauna från Ecuadorian Sierra: Representativa arterDessa spiraler kan sedan vara förknippade med att bilda en struktur som kallas protofilament eller protofibrilla, som har förmågan att montera med andra av samma typ.
Protofilament har N- och C-terminal icke-spiralformade ändar som är rika på cysteinrester och som är fästa vid den centrala regionen eller matrisen. Dessa molekyler polymeriseras för att bilda mellanliggande filament som har en diameter nära 7nm.
Två typer av mellanliggande filament sammansatta av keratin skiljer sig: de mellanliggande sura filamenten (typ I) och grunderna (typ II). Dessa är inbäddade i en proteinmatris och hur dessa filament beställs direkt påverkar de mekaniska egenskaperna hos strukturen som utgör.
I typ I -filament ansluter propellerna varandra med hjälp av tre ”spiralförbindelser” som kallas L1, L12 och L2 och som tros ge flexibilitet till det spiralformade domänen. I typ II -filament finns det också två underdomäner som är bland de spiralformade domänerna.
Exempel på en struktur med a-queratinas: hår
Om strukturen för ett typiskt hår analyseras har den en ungefärlig diameter på 20 mikron och består av döda celler innehåller.
 Däggdjurshår, som denna ko, består av keratin (källa: Frank Winkler via Pixabay.com)
Däggdjurshår, som denna ko, består av keratin (källa: Frank Winkler via Pixabay.com) Makropibriller består av mikrofibriller, som har mindre diameter och förenas med varandra genom ett amorft proteinsubstans med högt svavelinnehåll.
Dessa mikrofibriller är grupper av mindre protofibriller med ett 9+2 -organisationsmönster, vilket innebär att nio protofibrillor omger två centrala protofibriller; Alla dessa strukturer består i huvudsak av a-queratin.
Mjuka keratiner och hårda keratiner
Beroende på svavelinnehållet de har kan a-queratinas klassificeras som mjuka keratiner eller hårda keratiner. Detta har att göra med den mekaniska motståndskraften som införs av disulfidlänkarna i proteinstrukturen.
I gruppen hårda keratiner ingår de som ingår i håret, hornen och naglarna, medan mjuka keratiner representeras av de filament som finns i huden och kalluserna.
Disulfidbindningarna kan elimineras genom att applicera ett reducerande medel, så strukturerna som består av keratin är inte lätt smältbara av djur, såvida de inte har tarmar rika på varor, som är fallet med vissa insekter.
Det kan tjäna dig: Ficologyp-queratinas
Ss-det är mycket starkare än a-queratinas och finns i reptiler och fåglar som en del av klor, skalor, fjädrar och toppar. I gekkoerna består också de mikrovningar som finns i benen (svamp) av detta protein.
Dess molekylstruktur består av p-skalade ark bildade av antiparallete polypeptidkedjor som binder samman genom bindningar eller vätebroar. Dessa kedjor, bredvid varandra, bildar små styva och platta ytor, något vikta.
Var är du och vad är dina funktioner?
Keratinfunktionerna är framför allt relaterade till den typ av struktur som den bygger och platsen för djurets kropp där den ligger.
Liksom andra fibrösa proteiner ger detta stabilitet och strukturell styvhet till cellerna, eftersom det tillhör den stora proteinfamiljen känd som familjen med mellanliggande filament, som är proteiner från cytoskeletten.
I skydd och täckning
Det övre skiktet av huden på de övre djuren har ett stort nätverk av mellanliggande filament som bildas av keratin. Detta lager kallas epidermis och har mellan 30 mikron och 1 nm tjockt hos människor.
Epidermis fungerar som en skyddande barriär mot olika typer av mekanisk och kemisk stress och syntetiseras av en speciell typ av celler som kallas "keratinocyter".
Förutom överhuden finns det ett ännu mer externt lager som ständigt rör sig.
Espinas och Púas används också av olika djur för sitt eget skydd mot rovdjur och andra aggressorer.
Pangolinernas "rustning", några små insektivorösa däggdjur som bor i Asien och Afrika, består också av "skalor" av keratin som skyddar dem.
I försvar och andra funktioner
Hornen observeras hos djur i Bovidae -familjen, det vill säga hos kor, får och getter. De är mycket starka och resistenta strukturer och djuren som får dem att anställa dem som försvars- och fängelsekroppar.
Hornen bildas av ett bencentrum bestående av "svampigt" ben som täcks av hud som projiceras från skallens bakre zon.
 Naglar är ett annat exempel på kroppsdelar som består av keratin (källa: Adobe Stock via Pixabay.com)
Naglar är ett annat exempel på kroppsdelar som består av keratin (källa: Adobe Stock via Pixabay.com) Klor och naglar, förutom deras funktioner i mat och stöd, tjänar också djur som "vapen" -försvar mot angripare och rovdjur.
Kan tjäna dig: fixistteori: koncept, postulat och författareBird Peaks uppfyller flera syften, bland annat mat, försvar, fängelse, värmeväxling och toalett, bland andra. Flera varianter av picos hos fåglar finns i naturen, särskilt när det gäller form, färg, storlek och styrka hos de tillhörande käkarna.
Topparna är sammansatta, liksom hornen, av ett bencentrum som projiceras från skallen och är täckt med resistenta ß-queratinark.
Tänderna hos obeliska djur ("förfäder" ryggradsdjur) består av keratin och har, liksom tänderna på "överlägsna" ryggradsdjur, flera funktioner i mat och försvar.
I rörelsen
Hjälmarna hos många idisslare och ugulerade djur (hästar, åsnor, alces, etc.) De består av keratin, de är mycket motståndskraftiga och utformade för att skydda benen och samarbeta i rörelsen.
Fjädrarna, som också används av fåglar för att röra sig, består av p-cheap. Dessa strukturer har dessutom funktioner i kamouflage, i fängelse, i termisk isolering och i oförstörbarhet.
 Fjädrarna och fåglarnas topp består också av keratin (källa: cougeur, via pixabay.com)
Fjädrarna och fåglarnas topp består också av keratin (källa: cougeur, via pixabay.com) Inom industrin
Textilindustrin är en av de viktigaste exploaterna av de keratiniserade strukturerna, antropocentriskt sett. Ull och hår hos många djur är viktiga på industriell nivå, eftersom med dem olika plagg som är användbara för män från olika synpunkter tillverkas.
Referenser
- Koolman, J., & Roehm, K. (2005). Atlas av biokemi färg (2: a upplagan.). New York, USA: Thieme.
- Mathews, C., Van Holde, K., & Ahern, K. (2000). Biokemi (3: e upplagan.). San Francisco, Kalifornien: Pearson.
- Nelson, D. L., & Cox, M. M. (2009). Lehninger principer för biokemi. Omega -utgåvor (5: e upplagan.).
- Pauling, L., & Corey, r. (1951). Strukturen på hår, muskler och relaterade proteiner. Kemi, 37, 261-271.
- Phillips, D., Korge, b., & James, W. (1994). Keratin och keratinisering. Journal of the American Academy of Dermatology, 30(1), 85-102.
- Rouse, j. G., & Dyke, m. OCH. Gå. (2010). En översyn av keratinbaserade biomaterial för biomedicinska tillämpningar. Materiel, 3, 999-1014.
- Smith, f. J. D. (2003). Keratinsjukdomarnas molekylära genetik. Am J Clin Dermatol, 4(5), 347-364.
- Voet, D., & Voet, J. (2006). Biokemi (3: e upplagan.). Pan -American Medical Redaktion.
- Wang, b., Yang, w., McKitrick, J., & Meyers, m. TILL. (2016). Keratin: Struktur, mekaniska egenskaper, förekomst i biologiska organismer och ansträngningar vid bioinspiration. Framsteg inom materialvetenskap.
- « Nya Spanien och relationer med världsbakgrunden, rutter
- Repetitionens inlärningsegenskaper, fördelar, nackdelar »

