Chimotripsin -egenskaper, struktur, funktioner, verkningsmekanism
- 4034
- 396
- Anders Larsson
De chimotripsin Det är det näst vanligaste matsmältningsproteinet av bukspottkörteln mot tunntarmen. Det är ett enzym som tillhör familjen i serinproteas och specialiserar sig på hydrolys av peptidbindningarna mellan aminosyror som tyrosin, fenylalanin, tryptofan, metod och leukin närvarande i stort protein.
Namnet "kemotripsin" förenar faktiskt en grupp enzymer som produceras av bukspottkörteln och som aktivt deltar i tarmmatsmältning av proteiner hos djur. Ordet härstammar från reninverkan som detta enzym har på gastriskt innehåll eller "Chimo".
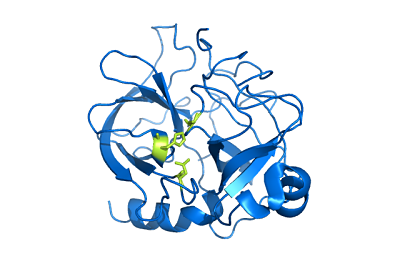
 Chimotripsinstruktur (källa: Användare: MattyJenjen [attribut] via Wikimedia Commons)
Chimotripsinstruktur (källa: Användare: MattyJenjen [attribut] via Wikimedia Commons) Även om det inte är känt exakt hur bred distributionen är i djurriket, anses det att dessa enzymer är närvarande åtminstone i alla lamm och det finns rapporter om deras närvaro i "mer primitiva kanter" som leddjur och den för celestroads.
I de djur som har bukspottkörtel är ett sådant organ huvudplatsen för chimotripsinproduktion, liksom andra proteaser, enzymatiska hämmare och föregångare eller zimogener.
Chimotripsins är de mest studerade och bättre karakteriserade enzymerna, inte bara i förhållande till deras biosyntes, utan också med deras aktivering från zimogen, dess enzymatiska egenskaper, dess hämning, dess kinetiska och katalytiska egenskaper och dess allmänna struktur.
[TOC]
Egenskaper och struktur
Chimotripsins är endopeptidaser, det vill säga de är proteaser som hydrolyserar peptidbindningar av aminosyror i "interna" positioner av andra proteiner; Även om det också har visats att de kan hydrolysera estrar, amidas och arilamidas, även om det är mindre selektivitet.
De har en genomsnittlig molekylvikt på cirka 25 kDa (245 aminosyror) och produceras från föregångare som är kända som kemotripsinogener.
Från bovina djur har två typer av kemotripsinogener renats, A och B. I grismodellen beskrivs en tredje kemotripsinogen, chimotripsinogen C. Var och en av dessa tre zimogener ansvarar för produktionen av chimotropsins A, B respektive C.
Det kan tjäna dig: Quintana Roo Flora och FaunaChimotripsin A bildas av tre polypeptidkedjor som är kovalent kopplade till varandra genom broar eller disulfidbindningar mellan cysteinrester. Det är emellertid viktigt att nämna att många författare anser att det är ett monomerat enzym (sammansatt av en enda underenhet).
Dessa kedjor utgör en struktur som har en ellipsoidform, där grupper som har elektromagnetiska belastningar finns mot ytan (med undantag för aminosyror som deltar i katalytiska funktioner).
Generellt sett är chimotropsiner extremt aktiva mot syra pH, även om de som har beskrivits och renats från insekter och andra icke -ryggradsdjur är stabila vid pH mellan 8 och 11 och extremt instabila för att sänka pH.
Kemotripsinfunktioner
När den exokrina bukspottkörteln stimuleras, vare sig av hormoner eller av elektriska impulser, frigör detta organ sekretoriska granuler som är rika på kemotripsinogen, som en gång når tunntarmen skärs av ett annat proteas mellan avfall 15 och 16 och sedan "automatiskt åtalas" för att utföra a helt aktivt protein.
Kanske är det huvudsakliga funktionen för detta enzym att agera i samarbete med de andra utsöndrade proteaserna mot mag -tarmsystemet för matsmältning eller nedbrytning av proteinerna som konsumeras med mat.
Produkterna från sådan proteolys fungerar därefter som en källa till kol och energi genom aminosyrakatabolism eller kan "återvinnas" direkt för bildandet av nya cellproteiner som kommer att utöva flera och varierande funktioner på fysiologisk nivå.
Handlingsmekanism
Chimotripsins utövar sina handlingar först efter att ha aktiverats, eftersom dessa produceras som "föregångare" (zimogen) former som kallas kemotropsinogena.
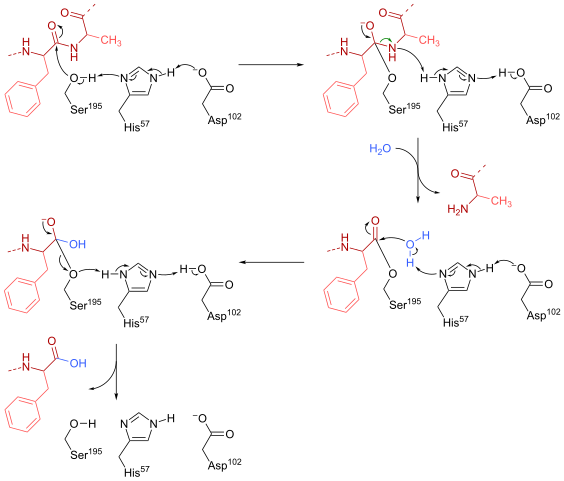 Quimotripsin -reaktionsmekanism (källa: HBF878 [CC0] via Wikimedia Commons)
Quimotripsin -reaktionsmekanism (källa: HBF878 [CC0] via Wikimedia Commons) Träning
Zimogenerna av chimotripsin syntetiseras av acinarcellerna i bukspottkörteln, varefter de migrerar från endoplasmatisk retikulum till Golgi -komplexet, där de är förpackade i membrankomplex eller sekretoriska granuler.
Kan tjäna dig: vetenskaper som är relaterade till biologiDessa granuler ackumuleras i ändarna av acinos och släpps som svar på hormonella stimuli eller nervimpulser.
Aktivering
Beroende på aktiveringsförhållanden kan flera typer av chimotripsins hittas, men de innebär alla det proteolytiska "snittet" av en peptidlänk i zimogen, chimotripsinogen, en process katalyserad av enzymtripsin.
Aktiveringsreaktionen består initialt av skärbindningen mellan aminosyror 15 och 16 i chimotripsinogen, som bildar π-kvimotripsin, som kan "självprocess" och fullständig autokatalysaktivering.
Handlingen av detta sista enzym främjar bildningen av After Peptider tillsammans med C-terminalkedjan, som börjar med rest 149).
De delar som motsvarar avfall 14-15 och 147-148 (två dipéptider) har inga katalytiska funktioner och lossning från huvudstrukturen.
Katalytisk aktivitet
Chimotripsin är ansvarig för hydrolysering av peptidbindningar och attackerar främst den karboxyliska delen av aminosyror som har aromatiska laterala grupper, det vill säga aminosyror som tyrosin, tryptofan och fenylalanin.
En serin (som är 195) inom den aktiva platsen (Gly-Asp-Series-Gly-Glu-Ala-Val) av denna typ av enzymer är kanske den viktigaste återstoden för dess operation. Reaktionsmekanismen är som följer:
- Chimotripsin finns initialt i en "substrat -fri" form, där den katalytiska "triaden" består av den laterala karboxylgruppen av en aspartatrester (102), imidazolringen av en histidinrest (57) och gruppsidan hydroxyl av A Serine (195).
- Substratet möter enzymet och går med i detta för att bilda ett typiskt enzym-substrat reversibelt komplex (enligt Micaelian-modellen), där den katalytiska "triaden" underlättar den nukleofila attacken genom att aktivera hydroxylgruppen i serinen i serin serin.
Det kan tjäna dig: kvävebaser: vad är, klassificering, funktioner- Nyckelpunkten för reaktionsmekanismen består i bildningen av en partiell länk, vilket resulterar i polariseringen av hydroxylgruppen, vilket är tillräckligt för att påskynda reaktionen.
- Efter den nukleofila attacken blir karboxylgruppen en tetraedral oxianion mellanhand, som stabiliseras av två vätebroar bildade av grupper N och H av Gly -resten 193 och är 195 år 195.
- Oxyanion är spontant "omarrang" och en enzymatisk mellanhand bildas till vilken en acylgrupp har lagts till (akyled enzym).
- Reaktionen fortsätter med inträde av en vattenmolekyl till det aktiva stället, en molekyl som främjar en ny nukleofil attack som resulterar i bildandet av en andra tetraedral mellanhand som också stabiliseras av vätebroar.
- Reaktionen slutar när denna andra mellanhand omarrangeras igen och bildar igen enzymsubstratet Micaelian-komplexet, där det aktiva platsen för enzymet är ockuperat av produkten i karboxylgruppen.
Referenser
- Appel, w. (1986). Chymotrypsin: Molekylära och katalytiska egenskaper. Clinical Biochemistry, 19 (6), 317-322.
- Bender, m. L., KillHeffer, J. V., & Cohen, s. (1973). Chymotrys. CRC Critical Reviews in Biochemistry, 1 (2), 149-199.
- Blow, D. M. (1971). 6 Strukturen för chymotrypsin. I enzymerna (Vol. 3, sid. 185-212). Akademisk press.
- Blow, D. M. (1976). Struktur och mekanism för chymotrypsin. Konton för kemisk forskning, 9 (4), 145-152.
- Nelson, D. L., Lehninger, a. L., & Cox, M. M. (2008). Lehninger principer för biokemi. Macmillan.
- Polgár, l. (2013). Katalytiska mekanismer för serin- och treoninpeptider. I handbok av proteolytiska enzymer (pp. 2524-2534). Elsevier Ltd.
- Westheimer, f. H. (1957). Hypotes för verkningsmekanismen för chymotrypsin. Proceedings of the National Academy of Sciences of the United States of America, 43 (11), 969.
- « Bensylsyrasyntes, transposition och användningar
- Visuella inlärningsegenskaper, strategier, aktiviteter, exempel »

