Exergoniska reaktionsegenskaper och exempel

- 2710
- 730
- PhD. Lennart Johansson
En exergononisk reaktion Det är en som inträffar spontant och som i allmänhet åtföljs av en frigöring av energi, antingen i form av värme, ljus eller ljud. När värme släpps sägs det att vi står inför en exotermisk och exergonisk reaktion.
Det är därför de "exotermiska" och "exergononiska" termerna är förvirrade och blir felaktigt behandlade som synonymer. Detta beror på att många exotermiska reaktioner också är exergoniska. Därför, om en stor frigöring av värme och ljus observeras, till exempel ursprunget till en eld, kan det antas att det består av en exergononisk reaktion.
 Träförbränning är ett exempel på en exotermisk och samtidigt exergononisk reaktion. Källa: Pixnio.
Träförbränning är ett exempel på en exotermisk och samtidigt exergononisk reaktion. Källa: Pixnio. Emellertid kan den frigjorda energin gå obemärkt och inte vara så överraskande. Till exempel kan ett flytande medium värmas upp något och ändå vara en konsekvens av en exergonisk reaktion. I vissa exergoniska reaktioner som passerar för långsamt observeras inte ens den lägsta temperaturökningen.
Den centrala och karakteristiska punkten för denna typ av termodynamiska reaktioner är minskningen av Gibbs fri energi i produkter med avseende på reagens, vilket innebär spontanitet.
[TOC]
Egenskaper för exergononiska reaktioner
Allmänt diagram
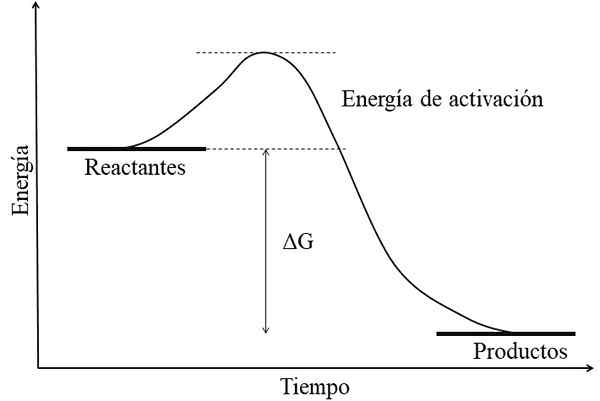 Energidiagram för en exergononisk reaktion. Källa: Gabriel Bolívar.
Energidiagram för en exergononisk reaktion. Källa: Gabriel Bolívar. Det huvudsakliga kännetecknet för en exergononisk reaktion är att produkterna har fria energier av GIBS lägre än de hos reaktanter eller reagens (överlägsen bild). Detta faktum är vanligtvis förknippat med produkterna är kemiskt mer stabila, med starkare länkar, mer dynamiska strukturer eller mer "bekväma" förhållanden.
Därför är denna energiskillnad, ΔG, negativ (ΔG < 0). Al ser negativa, la reacción en teoría debe ser espontánea. Sin embargo, otros factores también definen dicha espontaneidad, como lo son la energía de activación (la altura de la colina), la temperatura, y los cambios de entalpía y entropía.
Kan tjäna dig: homogent systemAlla dessa variabler som svarar på fenomenets eller den kemiska reaktionen som beaktas, gör det möjligt att bestämma om en reaktion kommer att vara exergonisk eller inte. Och det kommer också att ses att det inte nödvändigtvis behöver vara en exoterm reaktion.
När aktiveringsenergin är mycket hög kräver reaktanterna hjälp av en katalysator för att minska nämnda energibarriär. Det är därför det finns exergoniska reaktioner som ges i mycket låga hastigheter, eller som inte förekommer alls i första hand.
Fri energi minskar i systemet
Följande matematiska uttryck omfattar vad som kommenteras ovan:
ΔG = ΔH - TΔS
Termen ΔH är positiv om det är en endoterm reaktion och negativ om den är exotermisk. Om vi vill att ΔG ska vara negativt måste termen TΔS vara mycket stort och positivt, så att när vi subtraherar till ΔH är resultatet av operationen också negativt.
Därför, och detta är ett annat speciellt kännetecken för exergononiska reaktioner: de innebär en stor förändring i systementropin.
Således, med hänsyn till alla termer, kan vi vara närvarande före en exergonisk reaktion men samtidigt endotermisk; det vill säga med ΔH positivt, en mycket hög temperatur eller en förändring av stor entropi.
De flesta exergononiska reaktioner är också exotermiska, eftersom om ΔH är negativa, och genom att subtrahera en annan ännu mer negativ term kommer vi följaktligen att ha en ΔG med negativt värde; Såvida inte tδs är negativt (entropi sjunker), och därför skulle den exotermiska reaktionen bli endogonisk (inte spontan).
Det är viktigt att lyfta fram att spontaniteten hos en reaktion (vare sig exergonon eller inte) beror mycket på de termodynamiska förhållandena; Medan hastigheten med vilken den passerar beror på kinetiska faktorer.
Det kan tjäna dig: levande materia: koncept, egenskaper och exempelSpontanitet av en exergonisk reaktion
Det som har sagts är känt eftersom en exergononisk reaktion är spontan, oavsett om det är exotermiskt. Till exempel kan en förening lösa upp i vattenkylning tillsammans med behållaren. Denna upplösningsprocess är endoterm, men när det händer spontant sägs det att den är exergonisk.
Exoterm reaktion
Det finns "mer exergoniska" reaktioner än andra. För att ta reda på det bör följande uttryck vara till hands:
ΔG = ΔH - TΔS
De mest exergoniska reaktionerna är de som ges spontant till alla temperaturer. Det vill säga, oavsett värdet av t i det föregående uttrycket, är ΔH negativt och ΔS -positivt (ΔH 0). De är därför mycket exotermiska reaktioner, vilket inte motsäger den första idén.
Det kan också finnas exotermiska reaktioner där systementropin minskar (ΔS < 0); tal como sucede en la síntesis de macromoléculas o polímeros. En este caso, son reacciones exergónicas solamente a bajas temperaturas, ya que de lo contrario el término TΔS sería muy grande y negativo.
Endoterm reaktion
Å andra sidan finns det reaktioner som bara är spontana vid höga temperaturer: när ΔH är positiva och ΔS -positiva (ΔH> 0 och ΔS> 0). Vi pratar om endotermiska reaktioner. Det är därför temperaturstäder kan uppstå spontant, eftersom de har en ökning av entropin.
Samtidigt finns det reaktioner som inte är exergonon alls: när ΔH och ΔS har positiva värden. I det här fallet, oavsett temperaturen, kommer reaktionen aldrig att inträffa spontant. Vi pratar då, om ett slut -spontan endary reaktion.
Kan tjäna dig: sprida fasExempel på exergononiska reaktioner
Kemi kännetecknas vanligtvis av att vara explosiv och lysande, så det antas att de flesta reaktioner är exotermiska och exergoniska.
Förbränning
Exergoniska reaktioner är förbränningar av alkaner, olefiner, aromatiska kolväten, sockerarter, etc.
Metalloxidaxer
På samma sätt är metalloxidationer exergonon, även om de passerar långsammare.
Organismens kataboliska reaktioner
Det finns emellertid andra mer subtila processer, som också är exergoniska och mycket viktiga: de kataboliska reaktionerna i vår ämnesomsättning. Här sönderdelar makromolekyler som fungerar som energibehållare, frigör sig i värme och ATP, och tack vare vilken kroppen utför många av dess funktioner.
Det mest emblematiska av dessa reaktioner är cellulär andning, mittemot fotosyntes, där kolhydrater med syre "brändes" för att förvandla dem till små molekyler (CO2 och h2O) och energi.
Andra
Bland andra exergononiska reaktioner har vi den explosiva sönderdelningen av kvävet triayoduro, eller3; tillägget av vattenalkaliska metaller, följt av en explosion; polymersyntes av etoxylerade hartser; syrabasneutraliseringar i vattenlösning; och självlysande kemo -reaktioner.
Referenser
- Whitten, Davis, Peck & Stanley. (2008). Kemi. (8: e upplagan.). Cengage Learning.
- Walter J. Moore. (1963). Fysisk kemi. I kemisk kinetik. Fjärde upplagan, Longmans.
- Iran. Levin. (2009). Principer för fysikalik. Sjätte upplagan, sidan 479-540. MC Graw Hill.
- Wikipedia. (2020). Exergononisk reaktion. Hämtad från: i.Wikipedia.org
- Helmestine, Anne Marie, PH.D. (16 september 2019). Endergonic vs Exergonic Reaktion och process. Återhämtat sig från: tankco.com
- Exergonic reaktion: Definition & exempel. (18 september 2015). Återhämtat sig från: studie.com
- Khan akademin. (2018). Fri energi. Återhämtad från: är.Khan akademin.org
- « Mekaniska energiformler, koncept, typer, exempel, övningar
- Hållbar konsumtion för vad som används, betydelse, åtgärder, exempel »

