Aromatisk elektrofil substitutionsmekanism och exempel

- 5020
- 975
- Johan Olsson
De Aromatisk elektrofil substitution (Sear) Det är en organisk reaktion där en dålig art i elektroner, det vill säga en elektrofi, ersätter en av hydrogener i en aromatisk ring. Denna reaktion motsätter sig de tillägg som Alkenes lidit, vilket visar effekten av aromatisitet på reaktiviteterna hos bensen och dess derivat.
Elektrofilen, många gånger, genereras under samma molekylmekanism, produkt av blandningen av reagensen och en katalysator, som till exempel består av en syra av Lewis3 eller FECL3. Dessa katalysatorer ökar aviditeten för elektrofilen genom elektronerna i den aromatiska ringen och påskyndar därmed reaktionen.
 I den aromatiska elektrofila substitutionen är det bensenringen som attackerar elektrofilen. Källa: Gabriel Bolívar via Molview.
I den aromatiska elektrofila substitutionen är det bensenringen som attackerar elektrofilen. Källa: Gabriel Bolívar via Molview. I den överlägsna bilden har vi en enkel representation av den elektrofila attacken av bensen mot elektrofilen och+. Observera att attacken kommer från elektronerna i en av dess dubbelbindningar; det vill säga, det är elektronerna i det konjugerade π -systemet som startar Sear.
Denna reaktion gör det möjligt för bensen och andra aromatiska föreningar att förvärva substituenter som OH -grupper, inte2, Sw3H, CL, BR, R, COR, COCH3, bland andra. Till exempel syntetiseras fenolen via Sear från Benzene och andra derivat.
[TOC]
Aromatisk elektrofil substitutionsmekanism
Steg 1: Elektrofylattack
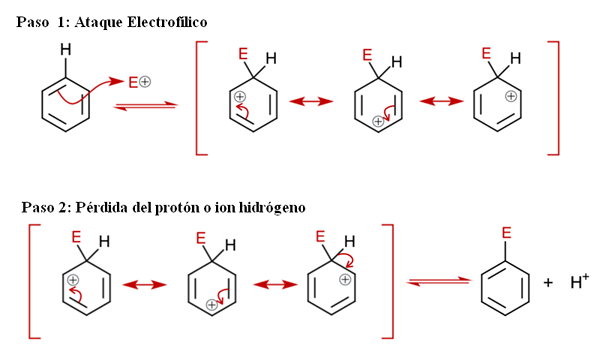 Allmän mekanism för Sear. Källa: Soonlorpai via Wikipedia.
Allmän mekanism för Sear. Källa: Soonlorpai via Wikipedia. I den överlägsna bilden representeras mekanismen för aromatisk elektrofil substitution mer detaljerat. Någon av de tre dubbelbindningarna av bensen attackerar elektrofilen och+, För att bilda en mellanhandsart känd som Ion Arenio (delokaliserad cyklohexadien), låst in röda parenteser.
Kan tjäna dig: kemisk nederbördObservera att den positiva belastningen på E+ Flytta nu till ringens inre. Men inte bara det: det flyttar mellan tre kolatomer i orto (intilliggande) positioner och för (motsatt) till kol kopplat till E (C-E). Denna mellanhand finns exakt tack vare den stabilitet som tilldelas av dess resonansstrukturer.
Steg 2: Förlust av proton- eller vätejonen
Areniojonen måste dock snart neutralisera sin positiva belastning genom att förlora en väteproton eller jon. Det är här ersättningen kulminerar. Elektrofil E+ ersätter därför en av bensenhydrogener och lämnar detta som jon h+ utanför ringen, så att positiva laddningar bevaras.
Om det observeras noggrant är alla steg i jämvikt, så ersättningen är reversibel. Det vill säga om koncentrationerna av H ökas+, då kommer ett väte att ersätta E och vi kommer att få reagensen igen.
Exempel på aromatisk elektrofil substitution
Bensen
Bensen Sear är den enklaste av alla, redan representerade ovan. Någon av hydrogener kan ersättas av E+, Eftersom alla är kemiskt likvärdiga.
Det finns inga skillnader från varandra. Därför är sannolikheten för att ersättning sker i en av de sex kolatomerna densamma. Allt förändras emellertid när det finns andra substituenter i bensenringen, som vi kommer att se nedan.
Fenol
Ortho, för och målattacker
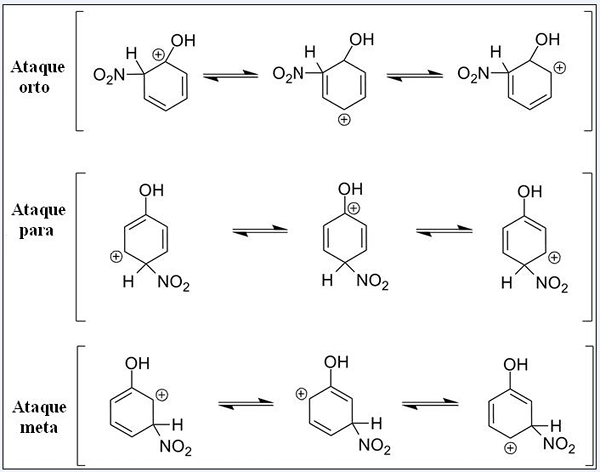 Resonansstrukturer för fenol i dess aromatiska elektrofil substitutionsreaktion. Källa: Pete Davis, allmän domän, via Wikimedia Commons
Resonansstrukturer för fenol i dess aromatiska elektrofil substitutionsreaktion. Källa: Pete Davis, allmän domän, via Wikimedia Commons Tänk nu Sear för fenolen. Den här gången är elektrofi den nitroniska katjonen, inte2+, som när man länkar till bensenringen omvandlas till nitro -gruppen, inte2.
Kan tjäna dig: nitrater: egenskaper, struktur, nomenklatur, träningNu när en OH -grupp är närvarande upphör de andra hydrogener att vara kemiskt ekvivalent; Vissa är mer mottagliga för att ersättas än andra. Och dessutom utövar OH ett direkt inflytande vid denna punkt.
Up Vi har tre ersättningar i olika positioner relaterade till OH: ortho attacker, för och mål. Observera att vi i alla tre har sandkatjonen och dess resonansstrukturer. I ortoattackerna och för den positiva belastningen inuti bensenringen ligger precis i kolet kopplat till OH; Medan du är i målattacken händer detta inte.
Åh som en ortho -grupp och för regissör
OH presenterar förmågan att ge elektroner till ringen via resonans och induktion. I båda kan det hjälpa till att "sprida" den positiva belastningen i det kol som det är kopplat och stabilisera följaktligen strukturen. Tvärtom, när målattacken inträffar kan OH inte stabilisera den positiva belastningen på samma sätt, strukturen är mer instabil.
Därför attackerar orto och för mer energi gynnad. Det sägs då att OH är en orto-för-regissörgrupp, som också kan aktivera bensenisk ring mot Sear. Det vill säga fenolen reagerar mycket snabbare än bensen, vilket demonstreras genom att mäta reaktionshastigheter.
Arilaminer
 Resonansstrukturer för anilin i dess aromatiska elektrofil substitutionsreaktion. Källa: V8Rik på engelska Wikipedia, CC BY-SA 3.0, via Wikimedia Commons
Resonansstrukturer för anilin i dess aromatiska elektrofil substitutionsreaktion. Källa: V8Rik på engelska Wikipedia, CC BY-SA 3.0, via Wikimedia Commons Fallet med arilaminerna, såsom anilin (överlägsen bild), liknar fenolens fenol. Observera att i sin mekanism denna gång stabiliseringen av den positiva belastningen på kväveatomen (h2N+=), hjälper ersättningen att vara orienterad mot orto -positioner och för, som med OH.
Det kan tjäna dig: Acid-Bass Theories: Arrhenius, Bronsted-Lowry, LewisNu är anilin mer reaktiv än fenol mot elektrofil substitution. Därför att? Eftersom kväveatomen är mindre elektronegativ än syre, varför den ger sitt par fria elektroner lättare till den aromatiska ringen. Syre, eftersom det är mer elektronegativt, ger ett av dess elektronpar med mindre "aviditet".
Dessutom är den atomiska radien för kväve närmare i kol. Detta påverkar det faktum att resonans sker särskilt mellan atomer med liknande radioapparater eller storlekar. Därför är resonansen mellan kol och kväve lite mer stabil och effektiv än den mellan kol och syre.
Klorbensen
I klorbensen, å andra sidan, bromsar Atom av CL substitutionen på grund av dess elektronegativitet. Och även om den också kan donera elektroner på grund av resonans till ringen, är dess atomradie betydligt större än kolet, vilket minskar det elektroniska bidraget.
Som svar reagerar klorbensen 50 gånger långsammare än bensen, eftersom dess ring är inaktiverad på grund av klor. Och också att locka elektroner mot sig själv, klor är en målgrupp, så substitutioner kommer främst att förekomma i den positionen.
Referenser
- Graham solomons t.W., Craig b. Fryhle. (2011). Organisk kemi. (10th Utgåva.). Wiley Plus.
- Carey f. (2008). Organisk kemi. (Sjätte upplagan). MC Graw Hill.
- Morrison och Boyd. (1987). Organisk kemi. (Femte upplagan). Addison-Wesley Iberoamericana.
- Wikipedia. (2020). Aromatisk förening. Hämtad från: i.Wikipedia.org
- ED Vitz et al. (8 september 2020). Aromatiska kolväten. Kemi librettexts. Återhämtad från: kem.Librettexts.org
- Wyman Elizabeth. (2020). Aromatiska kolväten: Definition, exempel och användning. Studie. Återhämtat sig från: studie.com
- Boluda, c. J., Macías, m., & González Marrero, J. (2019). Den kemiska komplexiteten hos fordonsbensin. Vetenskap, teknik och applikationer,2(2), 51-79. Doi: doi.org/10.22206/CYAP.2019.V2i2.Pp51-79
- « Termiska energiegenskaper, erhållning, överföring
- Aluminiumoxidstruktur, egenskaper, användning, nomenklatur »

