Fosforoxid (V) struktur, egenskaper, erhållning, användningar, risker

- 3573
- 408
- Johan Eriksson
han Fosforoxid (V) Det är ett oorganiskt fast ämne som bildas av fosfor (P) och syre (O). Dess empiriska formel är P2ANTINGEN5, Medan dess korrekta molekylformel är P4ANTINGEN10. Det är ett mycket hygroskopiskt vitt fast ämne, det vill säga det kan absorbera luft från luften mycket lätt, omedelbart reagera med detta. Reaktionen kan vara farlig eftersom den orsakar en snabb ökning av temperaturen.
Dess höga tendens att absorbera vatten har fått det att användas som torkmedel i kemiska laboratorier, samt uttorkning av vissa föreningar, det vill säga att eliminera vatten från dess molekyler.
 Fosforoxid (V) pulver, s4ANTINGEN10. LHCHEM [CC BY-S (https: // Creativecommons.Org/licenser/BY-SA/3.0)]. Källa: Wikimedia Commons.
Fosforoxid (V) pulver, s4ANTINGEN10. LHCHEM [CC BY-S (https: // Creativecommons.Org/licenser/BY-SA/3.0)]. Källa: Wikimedia Commons. Fosforoxid (V) används också för att påskynda bindningsreaktionerna hos molekyler av olika kolväten, som är en reaktion som kallas kondensation. Dessutom tillåter det att omvandla vissa organiska syror till estrar.
Det har till exempel använts för att förfina bensin, för att framställa fosforsyra h3Po4, För att erhålla föreningar som tjänar till att försena eld, tillverka glas för vakuumapplikationer, bland många andra användningsområden.
Fosforoxid (V) bör förvaras i välkastade containrar för att förhindra kontakt med fukten från luften. Det är frätande och kan skada ögon, hud och slem.
[TOC]
Strukturera
Fosforoxid (V) bildas av fosfor (P) och syre (O), där fosfor har valens av +5 och syre -2. Fosforoxidmolekylen (V) har fyra fosfor och tio syreatomer och det är därför dess korrekta molekylformel är P är P4ANTINGEN10.
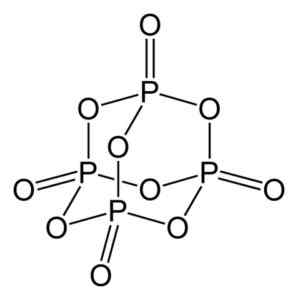 Struktur av fosforoxidmolekylen (V), P4ANTINGEN10. Författare: Benjah-Bmm27. Källa: Wikimedia Commons.
Struktur av fosforoxidmolekylen (V), P4ANTINGEN10. Författare: Benjah-Bmm27. Källa: Wikimedia Commons. Finns i tre kristallina former, såsom amorft damm och i en glasform (som glas). I den hexagonala kristallina formen finns var och en av fosforatomerna i topparna hos en tetrahedron.
Nomenklatur
- Fosforoxid (V)
- Fosforpentoxid
- Pentoxid
Kan tjäna dig: lösningsmedel: koncept, typer och exempel- Fosforpentoxid
- Fosforhydrid
- Tetrafosfor förfall
Egenskaper
Fysiskt tillstånd
Kristallint vitt fast ämne. Den vanligaste formen är den av hexagonala kristaller.
Molekylvikt
283,89 g/mol
Smältpunkt
562 ºC
Sublimeringstemperatur
360 ºC till 1 tryckatmosfär. Det betyder att vid denna temperatur passerar från gasfast utan att gå igenom det flytande tillståndet.
Densitet
2,30 g/cm3
Löslighet
Mycket lösligt i vatten. Svavelsyrasyra. Olöslig i aceton och ammoniak.
Kemiska egenskaper
Fosforoxid (V) absorberar och reagerar med luft från luften med extrem snabbt bildande fosforsyra H3Po4. Denna reaktion är exoterm, vilket innebär att värme produceras under samma.
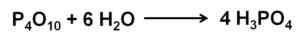 Fosfor (V) oxidreaktion med vatten för att bilda fosforsyra H3Po4. Författare: Marilú Stea.
Fosfor (V) oxidreaktion med vatten för att bilda fosforsyra H3Po4. Författare: Marilú Stea. Reaktionen från P4ANTINGEN10 Med vatten leder till bildandet av en blandning av fosforsyror vars sammansättning beror på mängden vatten och förhållanden.
Reaktionen med alkoholer leder till bildning av fosforsyra eller polymerinsyraestrar beroende på experimentella förhållanden.
P4ANTINGEN10 + 6 ROH → 2 (RO)2Po.Oh + 2 ro.PO (OH)2
Med grundläggande oxider bildar fasta fosfater.
Det är frätande. Det kan reagera farligt med myrsyra och oorganiska baser såsom natriumhydroxid (NaOH), kalciumoxid (CAO) eller natriumkarbonat NA2Co3.
Om en HCLO -perclorinsyralösning hälls4 och CHCL -kloroform3 I fosforoxid (V) p4ANTINGEN10 En våldsam explosion inträffar.
Andra egenskaper
Det är inte brandfarligt. Gynnar inte förbränning. Vattenreaktionen är emellertid så våldsam och exoterm att det kan finnas en brandrisk.
Erhållande
Det kan framställas genom direkt fosforoxidation i en torr luftström. Fosfor När syreöverskottskontakt oxideras och bildar fosforoxid (V).
P4 + 5 o2 → P4ANTINGEN10
Närvaro
Fosforoxid (V) finns i mineraler som ilmenit, rutilo och zircón.
Kan tjäna dig: vad är oorganiska kemiska funktioner?Ilmeniten är ett mineral som innehåller järn och titan och ibland har fosforoxid i koncentrationer som varierar mellan 0,04 och 0,33 viktprocent. Rutilo är ett titanoxidmineral och kan innehålla cirka 0,02 viktprocent P2ANTINGEN5.
Zircón Sands (ett zirkoniumelementmineral) har fosfor (V) oxid vid 0,05-0,39 viktprocent.
Ansökningar
Som en dehydratisering och sekantagent
På grund av dess stora aviditet för vatten är det ett av de mest kända och mycket effektiva dehydratiseringsmedel vid temperaturer mindre än 100 ° C.
Kan extrahera vatten från ämnen som betraktas som uttorkningsmedel. Till exempel kan du ta bort vatten från svavelsyra h2Sw4 gör det så3 och salpetersyra hno3 förvandla det till n2ANTINGEN5.
 Svavelsyratorkning på grund av fosforoxid (V). Författare: Marilú Stea.
Svavelsyratorkning på grund av fosforoxid (V). Författare: Marilú Stea. I grund och botten kan det torka alla de vätskor och gaser som den inte reagerar, så det gör det möjligt att ta bort spår av fukt från vakuumsystem.
I organisk kemi -reaktioner
Fosforoxid (V) tjänar till att stänga organiska sammansatta ringar och andra kondensreaktioner.
Det gör det möjligt att sterifiera organiska syror med möjligheten att skilja mellan primära alifatiska karboxylsyror (kolsyrade kedja utan ringar med -cooh -gruppen i ena änden) och aromatiska syror (grupp -COH kopplade till bensenringen), eftersom den senare inte reagerar reagerar.
Det tjänar också till att eliminera en H -molekyl2Eller av amidas r (c = o) nh2 Och det gör dem till nitriler R-CN. Dessutom katalyserar eller påskyndar syresättning, dehydrogenering och polymerisation av bitumenreaktioner.
 P4ANTINGEN10 Det används allmänt i organiska kemilaboratorier. Författare: JDN2001CN0. Källa: Pixabay.
P4ANTINGEN10 Det används allmänt i organiska kemilaboratorier. Författare: JDN2001CN0. Källa: Pixabay. I bränsle raffinering
Sedan 1930 -talet av det tjugonde århundradet indikerade vissa studier att fosfor (V) oxid utövade en gasförädling, vilket ökade dess oktan.
Rädningsåtgärden för P4ANTINGEN10 Det beror främst på kondensationsreaktioner (förening av olika molekyler) och inte av polymerisation (bindning av lika molekyler).
Kan tjäna dig: natriumacetat: struktur, egenskaper, syntes, användningarP4ANTINGEN10 Accelererar direkt alomatiska kolväten med olefin kolväten, olefinomvandling till naftens och partiell polymerisation. Alkyleringsreaktionen ökar oktanantalet bensin.
På detta sätt erhålls en högkvalitativ förfinad bensin.
 Vissa oljederivat kan förbättras genom verkan av P4ANTINGEN10 I dess molekyler. Författare: DrPeperscott230. Källa: Pixabay.
Vissa oljederivat kan förbättras genom verkan av P4ANTINGEN10 I dess molekyler. Författare: DrPeperscott230. Källa: Pixabay. I olika applikationer
Fosforoxid (V) tjänar:
- Förbered fosforsyra h3Po4
- Skaffa akrylat- och ytaktiva estrar
- Förbered fosfatestrar som används som flamskyddare, lösningsmedel och utspädningsmedel
- Fosfor trikloridomvandling till fosforoxiklorid
- Laboratoriefritten
- Tillverkningsspecialglasögon för vakuumrör
- Öka asfaltsmältpunkten
- Tjäna som en standardmolekyl i bestämningen av fosfor eller fosfater i fosfatisk berg, gödselmedel och portlandcement, i form av P2ANTINGEN5
- Förbättra länkarna mellan vissa polymerer och elfenbenskiktet som tänderna har
 Vissa specialglasögon som vakuumrör måste använda P4ANTINGEN10 under tillverkningen. Tvezymer [public domain]. Källa: Wikimedia Commons.
Vissa specialglasögon som vakuumrör måste använda P4ANTINGEN10 under tillverkningen. Tvezymer [public domain]. Källa: Wikimedia Commons. Risker
Fosforoxid (V) måste hållas i förseglade behållare och på färska, torra och väl ventilerade platser.
Detta tjänar till att förhindra att det inte kontaktar vatten, eftersom det kan reagera våldsamt med det, generera mycket värme, till att bränna närliggande material som är brännbara.
Fosforoxid (V) damm är irriterande öga och luftvägar och frätande för huden. Det kan producera brännskador i ögonen. Genom intag orsakar dödliga interna brännskador.
Referenser
- ELLER.S. National Library of Medicine. (2019). Fosforhydrid. Återhämtat sig från pubchem.Ncbi.Nlm.Nih.Gov.
- Nayler, s. (2001). Bitumen: modifierad. Kemisk modifiering. I encyklopedi av material: vetenskap och teknik. Återhämtat sig från Scientedirect.com.
- Malishev, f.W. (1936). Fosforpentoxid som raffineringsmedel för bensin. Industrial & Engineering Chemistry 1936, 28, 2, 190-193. Återhämtat sig från pubar.ACS.org.
- Epps, jr. OCH.TILL. (1950). Fotometrisk bestämning av tillgänglig fosforpentoxid hos gödselmedel. Analytisk kemi 1950, 22, 8, 1062-1063. Återhämtat sig från pubar.ACS.org.
- Banerjee, a. et al. (1983). Användning av fosforpentoxid: Förestering av organiska syror. J. Org. Kem. 1983, 48, 3108-3109. Återhämtat sig från pubar.ACS.org.
- Bomull, f. Albert och Wilkinson, Geoffrey. (1980). Avancerad oorganisk kemi. Fjärde upplagan. John Wiley & Sons.
- Kirk-THERMER (1994). Encyclopedia of Chemical Technology. Fjärde upplagan. John Wiley & Sons.
- Ogliari, f.TILL. et al. (2008). Syntes av fosfatmonomerer och bindning till dentin: förestringsmetoder och användning av fosforpentoxid. Journal of Dentistry, Volym 36, nummer 3, mars 2008, sidorna 171-177. Återhämtat sig från Scientedirect.com.
- « Aluminiumacetat (AL (CH3CO) 3) Struktur, egenskaper, användningar
- Notation utvecklade vad som är, exempel och övningar »

