Natriumjodid (NAI) struktur, egenskaper, användningar, risker

- 4740
- 245
- Johan Johansson
han natriumjodid Det är en oorganisk förening bildad av en natrium Na -atom och en jodatom. Dess kemiska formel är nai. Det är ett vitt fast ämne som tenderar att absorbera vatten från miljön, det vill säga det är hygroskopiskt. Så hygroskopiskt att det sägs att det är delikoscerande, för när tiden går löses den i vattnet som har absorberats.
Natriumjodid har flera tillämpningar inom medicinområdet, till exempel tjänar det till att göra bronkialsekretioner mindre tjocka (slem), så det används för att behandla bronkit och astma.
 Fast NAI -natriumjodid. Ingen maskinläsbar författare tillhandahållen. Walkerma antas (baserat på upphovsrättsanspråk). [Allmängods]. Källa: Wikimedia Commons.
Fast NAI -natriumjodid. Ingen maskinläsbar författare tillhandahållen. Walkerma antas (baserat på upphovsrättsanspråk). [Allmängods]. Källa: Wikimedia Commons. Eftersom elementjodet är ett mikronäringsämne för kroppen, används Nai -natriumjodiden i de lösningar som injiceras i patienter som inte kan matas genom munnen. Det används också i vissa enheter som tjänar till att upptäcka sjukdomar genom gammastrålning.
Det har en viktig användning inom veterinärmedicin för att behandla olika sjukdomar hos djur, främst däggdjur. NAI används också som ett reagens i Organic Chemistry Laboratories.
[TOC]
Strukturera
Natriumjodid bildas av en natrium -katjon+ och en jodidjon i-, Därför är det en jonisk förening.
 Yoduro -anjon i- (Stor) och natriumkatjon NA+ (liten). Claudio Pistilli [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenser/BY-SA/4.0)]. Källa: Wikimedia Commons.
Yoduro -anjon i- (Stor) och natriumkatjon NA+ (liten). Claudio Pistilli [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenser/BY-SA/4.0)]. Källa: Wikimedia Commons. Jodidjonen är mycket större än natriumjonen, men i det fasta ämnet är de perfekt kopplade till kubiska kristaller.
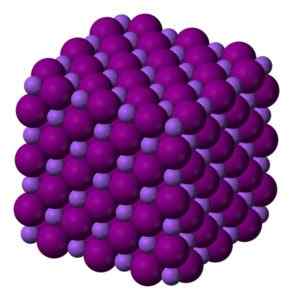 I det fasta NAI -glaset är natrium- och jodidjoner perfekt kopplade och bildar ett kubiskt glas. Benjah-Bmm27 [Public Domain]. Källa: Wikimedia Commons.
I det fasta NAI -glaset är natrium- och jodidjoner perfekt kopplade och bildar ett kubiskt glas. Benjah-Bmm27 [Public Domain]. Källa: Wikimedia Commons. Nomenklatur
Natriumjodid
Egenskaper
Fysiskt tillstånd
Vitt fast av delningskristaller (absorbera vatten snabbt från miljön). Kubikkristaller.
Molekylvikt
149,89 g/mol
Kan tjäna dig: Justus von LiebigSmältpunkt
661 ° C
Kokpunkt
1304 ° C
Densitet
3,67 g/cm3
Löslighet
Mycket lösligt i vatten: 184 g/100 ml vatten vid 25 ° C. Alkohollöslig: 42,57 g/100 ml alkohol. Acetonlöslig: 39,9 g/100 ml aceton.
pH
8-9.5 (den är beredd något alkalisk för att vara mer stabil).
Kemiska egenskaper
Den blir brun om den utsätts för luften, eftersom den släpper jod i2. Dina vattenhaltiga lösningar påverkas på liknande sätt.
Natriumjodid NAI reagerar med oxiderande medel som producerar jod I2. Med mycket starka oxiderande medel som perklorsyra kan reaktionen vara våldsam.
Andra egenskaper
Det är delikoscerande, det vill säga mycket hygroskopiskt. Absorbera snabbt miljöfuktighet. Kan absorbera upp till 5% av sin vattenvikt.
Saltlösning och lite bitter.
Erhållande
Natriumjodid kan erhållas från jod I2 NaOH natriumhydroxid. Det kan också framställas genom reaktion mellan natriumkarbonat och en sur jodidlösning.
Användningar inom medicin
För astma- och bronkitbehandling
NAI används som en slemhjälpare när det finns mycket ihärdiga bronkiala sekret, det tjänar till Liquef.
 Bronkierna är den grenade delen av lungorna. I vissa fall kan bronkit behandlas med natriumjodid. Författare: OpenClipart-Vectors. Källa: Pixabay.
Bronkierna är den grenade delen av lungorna. I vissa fall kan bronkit behandlas med natriumjodid. Författare: OpenClipart-Vectors. Källa: Pixabay. Det används vid bronkit och astma. Det bör inte administreras efter att hosten har "lossat". Men hos patienter med kronisk bronkit eller astma kan det förskrivas mer eller mindre kontinuerligt om lättnad uppnås.
I intravenös mat
Natriumjodid är en källa till jod och kan levereras som ett tillägg för total parenteral näring, som är en typ av intravenös mat.
Vid diagnos och behandling av sköldkörteln
I sin radioaktiva form har NAI använts som ett diagnostiskt verktyg för att utvärdera sköldkörtelfunktionen och strukturen hos vissa patienter.
Kan tjäna dig: periodisk tabell, vad är det förNatriumjodidterapi har använts för att behandla hypertyreos, men kontrollerar vanligtvis inte helt manifestationerna av sjukdomen och efter ett tag försvinner dess gynnsamma effekt.
Genom att fortsätta behandlingen med jodid kan hypertyreosen återgå till sin initiala intensitet eller kan bli allvarligare än i början.
I gammakameror
Gamma -kameror är instrument som gör det möjligt att fånga bilder härrörande från gammastrålning. De används i kärnmedicin för diagnos av vissa sjukdomar.
Gamma -kammaren använder en natriumjodidkristall som en gammastrålningsdetektor från patienten, som har injicerats intravenöst en mycket liten mängd av ett radioaktivt ämne.
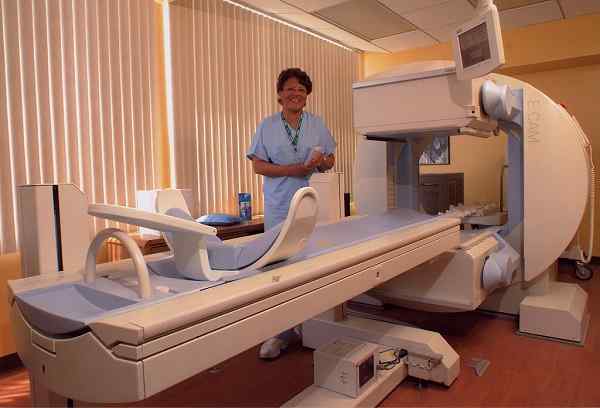 GAMMA -kamerautrustning, som gör att du kan upptäcka vissa sjukdomar genom gammastrålning. Brendaicm [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenser/BY-SA/3.0)]. Källa: Wikimedia Commons.
GAMMA -kamerautrustning, som gör att du kan upptäcka vissa sjukdomar genom gammastrålning. Brendaicm [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenser/BY-SA/3.0)]. Källa: Wikimedia Commons. I veterinärmedicin
I veterinärmedicin har det använts för att eliminera ringade maskar, i cancerskador och vid vissa inflammatoriska sjukdomar hos hundar av hundar.
Det används för att behandla mykos, kroniska ledinflammationer, laryngit, bronkit och pleurit hos vissa djurarter. Det används för att ta bort maskar från katter från katter.
 Vissa kattsjukdomar kan behandlas med natriumjodid. Författare: Skeze. Källa: Pixabay.
Vissa kattsjukdomar kan behandlas med natriumjodid. Författare: Skeze. Källa: Pixabay. Det används också som ett medel för x -utslag av urinblåsan i vissa djur.
Natriumjodid används som hjälp vid behandling av aktinomycos och aktinobacillos hos nötkreatur (det kan vara hos kor, får och getter).
Actinomycosis eller "gummikäken" är en infektion i käkbenen, där benen ökar i storlek, orsakar smärta och djuret kan inte matas ordentligt.
Actinobacillosis eller "träkunga" är en tunginfektion som sväller och djuret kan inte tugga mat.
Kan tjäna dig: svavelsyra (H2SO4)Natriumjodid bidrar med andra mediciner för att bota båda sjukdomarna.
Natriumjodid används också som släcktätare vid sjukdomar hos kor, hästar och får.
 Vissa sjukdomar som påverkar kor kan behandlas med nai -nai -jodid. Författare: Ulrike Leone. Källa: Pixabay.
Vissa sjukdomar som påverkar kor kan behandlas med nai -nai -jodid. Författare: Ulrike Leone. Källa: Pixabay. Andra användningsområden
I organisk kemi -reaktioner
Natriumjodid var en av de första salterna som används för att döda.
För att extrahera förorenad sandmikroplastik
Natriumjodid har använts för att extrahera mikroplast (mycket små plaststycken) av sand förorenad med detta material.
Mikroplastiska föroreningar har observerats i olika naturliga miljöer, såsom floder, sjöar, hav, hav, kuster och till och med i ubåtmiljöer, så det är ett globalt problem.
Mikroplast intas av marina och landdjur som orsakar allvarliga hälsoskador.
 Plast som kasseras på stränderna leder till hög förorening av sand och hav. Med natriumjodid kan du mäta hur mycket mikroplast det finns i sanden. Författare: h. Hach. Källa: Pixabay.
Plast som kasseras på stränderna leder till hög förorening av sand och hav. Med natriumjodid kan du mäta hur mycket mikroplast det finns i sanden. Författare: h. Hach. Källa: Pixabay. Måttet på mängden mikroplast som ett visst område har utförs genom att ta en del av sand och fördjupa den i natriumjodidlösningen.
På detta sätt flyter mikroplasten. Natriumjodidlösningar har tillräcklig densitet för plastmikropartiklar att flyta, till och med den tätaste plasten.
Även om natriumjodid är dyra utformas metoderna för att återanvända och minska kostnaderna för denna procedur.
Risker
Om natriumjodid kommer i kontakt med HCLO4 percloric acid.
Det är irriterande för ögon, hud och luftvägar. Intaget kan påverka sköldkörteln. Det kan orsaka sensibilisering i kroppen.
Det är skadligt för fostret hos gravida kvinnor, för om de äter det eller andas in kan det orsaka döden för barnet eller mycket allvarlig och permanent skada.
Överdosering av natriumjodid kan orsaka "jod" som kännetecknas av överskott av saliv, nysningar, konjunktivit, huvudvärk, feber, laryngit, bland andra symtom.
Referenser
- ELLER.S. National Library of Medicine. (2019). Natriumjodid. Nationellt centrum för bioteknikinformation. Återhämtat sig från pubchem.Ncbi.Nlm.Nih.Gov.
- Cherry, s.R. et al. (2012). Gammakameran. I fysik i kärnmedicin (fjärde upplagan). Återhämtat sig från Scientedirect.com.
- Kedziersski, m. et al. (2016). Effektiv extraktion av mikroplast från sand. En kostnadseffektiv metod baserad på natriumjodidåtervinning. Marine Pollution Bulletin 2016, återhämtade sig från Elsevier.com.
- Van Meter, D.C. et al. (2008). Infektionssjukdomar i mag -tarmkanalen. I Rebeuns Deseses of Dairy Cattle. Återhämtat sig från Scientedirect.com.
- Fry, A.J. (1991). Minskning. Genom att förstå organisk syntes. Återhämtat sig från Scientedirect.com.
- Young, J.TILL. (2004). Natriumjodid. Journal of Chemical Education, Vol. 81, nej. 3, mars 2004. Återhämtat sig från pubar.ACS.org.
- « Natriumsilikat (Na2Sio3) struktur, egenskaper, användningar, risker
- Cirkelens omkrets Hur man får ut den och formler, lösta övningar »

