Svag syra
- 1828
- 490
- Johan Johansson
 Svaga syraexempel
Svaga syraexempel Vad är en svag syra?
En svag syra är en som i vattenhaltig lösning har liten kapacitet att dissociera i väte (h+) och i motsvarande konjugerad bas. Till skillnad från starka syror, vars dissociation är fullständig (100%) och praktiskt taget irreversibla, svaga syror är knappt dissocierade och reversibla.
Därför genererar en svag syra mindre honer h+ I vatten av vad som kan förväntas. Bland de mest representativa svaga syrorna har vi ättiksyra, huvudkomponenten i vinäger, som är ungefär i en 0.5 % under normala förhållanden.
Detta innebär att den största andelen av en ättiksyralösning i vatten, såsom 5%matlagning vinäger, är i icke -dissocierad form (CH3COOH); Medan en liten del hittas som konjugatbasen (välj3Kuttra-), åtföljd av hjoner+, eller mer korrekt, hjoner3ANTINGEN+.
Sedan, eftersom mängden väte som frigörs av en svag syra i vattenlösning är låg, är pH de producerar högre (grundläggande) än den som produceras av en stark syra. Till exempel har vinäger ett pH på 2.5, apelsinjuice pH 3.3. 4.2 och 2 citronsaft av 2.
Dessa pH, även om de är sura, är högre än pH som ger en lösning av en stark syra (HCl, H2Sw4, etc.) att de kan nå värdet av 1 eller mindre (negativa pH -värden).
Egenskaper hos svaga syror
ph i dina lösningar
Svaga syror har vanligtvis ett pH mellan 2.0 och mindre än 7.0, så de vänder färgen på pannasolpapperet i rött. Dessa pH -värden är många högre än pH -värdena som produceras av starka syror, även om det finns undantag.
Till exempel har en 1 mM saltsyralösning (en stark syra) ett pH på 3.0, medan en 1 mM -lösning av fluorhorinsyra (en "svag" syra), har ett pH på 3.2, som är nära den för stark syra.
Partiell jonisering
Svaga syror i lösningen är joniserade lite eller delvis i vatten, och dissocierar i den konjugerade basen av syra och vätejon. Sedan är en svag syra i vattenhaltig lösning oftast dissocierad, med en liten dissocierad proportion.
Kan tjäna dig: balansering av kemiska ekvationerNär mängden väte som frigörs av en svag syra i vatten är låg, är pH som produceras av denna syra högre än den som produceras av en stark syra upplöst i vatten, eftersom dessa vanligtvis joniseras med 100 %.
Reversibel jonisering
Joniseringen av en svag syra schematiseras vanligtvis enligt följande:
Har ⇌ a- + H3ANTINGEN-
Var finns det svag syra, till- dess konjugerade bas och h3ANTINGEN+ hydroniumkatjonen, vilket är vägen i h+ Det finns eller manifesteras i vattnet. Koncentrationen (eller aktiviteten) av h3ANTINGEN+ Det används istället för h+ För bestämning av lösningen av lösningen.
Joniseringsgrad
Vissa syror är svagare än andra, vilket är samma att säga, de är mindre joniserade. Därför tillåter joniseringsgraden oss att skymta hur sur en syra under vissa förhållanden är.
För att uttrycka graden av jonisering infördes flera parametrar, såsom jonisering eller surhetskonstant (KA) och PKA: ett sätt att uttrycka KA i ett enkelt nummer som utelämnar användningen av ett antal uttryckta i negativa krafter på tio (10 ), som det finns i KA.
KA- och PKA -konstanter används främst för svaga syror.
Ka = [a-] [H+] / [Ha]
De konsoler som finns i formeln representerar koncentrationer.
pka = - log ka
PKA -värdet på en svag syra sträcker sig vanligtvis mellan 2 och 12. Men det finns undantag. Till exempel: och och odagisk syra (Hio3) har en pka på 0.77, som anses vara ett relativt litet värde, men utan att vara negativ, för en svag syra i strikt mening.
Konjugatbasstabilitet
Svaga syror har en stark bindning med syra väteatom (hΔ+-XΔ-), så de har en låg grad av dissociation av väte. Detta resulterar i den konjugerade basen av svag syra har stor aviditet genom väte, att vara en stark konjugerad bas.
Kan tjäna dig: kolloidDet vill säga den konjugerade basen för en svag syra är mycket instabil, eftersom den accepterar h+ återvände mycket lätt. Ju mer instabil denna konjugerade bas, desto svagare kommer syran att vara ifrågasatt.
Låg jonkonduktivitet
Som lilla joniserade är svaga syror dåliga elektricitetsledare, till skillnad från starka syror som är goda elektricitetsledare.
Närvaro
Svaga syror är allmänt fördelade i naturen, till exempel är de i citrusfrukter (citron, grapefrukt, orange osv.).
De finns också i många processer som förekommer i alla levande varelser. Några av dessa biologiska svaga syror är pyruviska, mjölk, citriska, fumariska, suwciniska, glutamiska, etc., och till och med syresatt hemoglobin släpper väten, så det uppträder som en svag syra.
Då kan man dra slutsatsen att människan lever i permanent kontakt med svaga syror.
Hur man beräknar pH för en svag syra?
PH för en svag syra kan beräknas med hjälp av Acidicalization Constant (KA) eller med användning av Henderson-Haselbalch-ekvationen. I det första exemplet kommer KA att användas.
Med surhetskonstant
Beräkna pH för en lösning 0.5 m bensoesyra (c6H5COOH), som har en joniseringskonstant (KA) = 1.8 x 10-5
C6H5Cooh ⇌ c6H5Kuttra- + H+ (1)
Om mängden syra som dissocierar kallas x, då 0.5 m-x kommer att vara koncentrationen av svag syra som inte är dissocierad i jämvikt, och är x koncentrationen av konjugatbasen för bensoesyra och vätejonkoncentration.
Ekvation (1) kan representeras enligt följande:
0.5 m-x ⇌ x +x
Svaga syror joniseras i en mycket låg andel, så koncentrationen av bensoesyra i balansen mellan (0.5 m-x), kan antas som 0.5 m, sedan x <<< 0.5. Sustituyendo en la expresión de Ka resolvemos para X:
Ka = [a-] [H+] / [Ha]
1.8 x 10-5 = (X) (x) / 0.5 m
X2 = (1.8 x 10-5) (0.5m)
X = 3 x 10-3 M
Därför [h+] är lika med 3 x 10-3 M. Vi löser sedan genom att beräkna pH:
Det kan tjäna dig: MOHR -metod: Grundläggande, reaktioner, procedur, användningpH = - log [h+]
= - log [3 x 10-3]
pH = 2.52
Observera att pH är relativt surt, eftersom det ligger under 3 eller 4.
Med Henderson-Haselbalch-ekvation
Henderson-Haselbalch-ekvation används för att beräkna pH för en buffertlösning:
pH = pKa + log [konjugerad bas] / [syra]
Exempel:
Natriumhydroxid (NaOH) tillsätts till en ättiksyralösning och ger en slutlig koncentration av ättiksyra (CH3COOH) 1.11 x 10-2 Mol/L och en konjugerad baskoncentration (välj3Kuttra-) av 0.44 x 10-2 mol/l. Om ättiksyra PKA är 4.75 Beräkna lösningens pH.
pH = 4.75 +log [a-] / [Ha]
pH = 4.75 +log (0.44 x 10-2 / 1.11 x 10-2)
= 4.75+ log 0.396
= 4.348
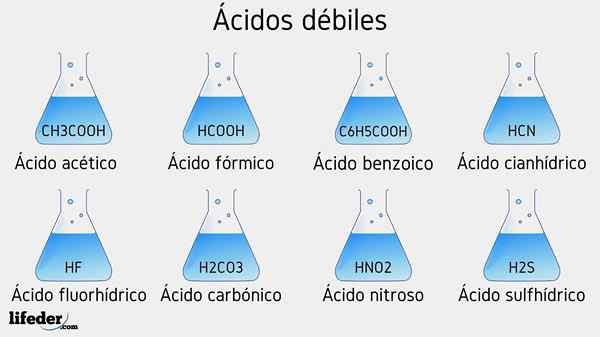
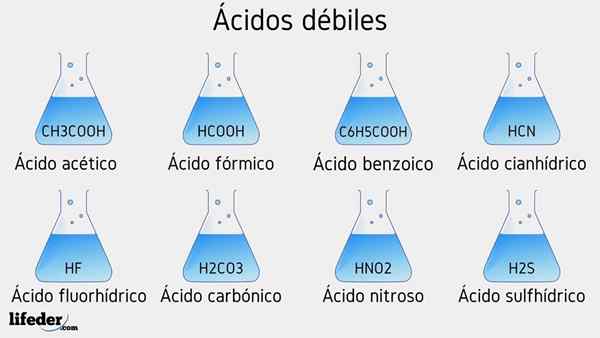
Svaga syraexempel
Flera svaga syror åtföljda av deras PKA -värden kommer att listas nedan:
- Ch3COOH (ättiksyra), PKA 4.75
- HCOOH (myrsyra), PKA 3.74
- C6H5COOH (bensoesyra), PKA 5.59
- Ch2ClcoH (klorättiksyra), PKA 2.85
- HCN (cyanhydronsyra), PKA 9.31
- Hf.17
- C2H5COOH (propionsyra), PKA 4.89
- Hno2 (Kvävesyra), PKA 3.35
- H2S (sulfidsyra), PKA1 6.0 och PKA2 12.92
- Ccl3COOH (triklorättiksyra), PKA 0.52
- H2Co3 (Carbonsyra), PKA1 6.37 och PKA2 10.22
- H3Po4 (fosforsyra), PKA1 2.12, PKA2 4.21 och PKA3 elva.0
- C6H5Sw3H (Benzefonsyra), PKA 0.70
- Hio3 (Yodiumsyra), PKA 0.77
- Hclo2 (Klorsyra), PKA 2.0
- Ch3Ch2(OH) COOH (mjölksyra), PKA 3.08
Svaga syror med terapeutiska användningar
- Salicylsyra, PKA 3.00
- Acetylsalicylsyra, PKA 3.49
- Furosemide, PKA 3.90
- Ibuprofen, pka 4.40
- Levodopa, pka 2.30
- Fenobarbital, pka 7.40
- Warfarina, PKA 5.0
- Teofilina, PKA 8.80
Referenser
- Whitten, Davis, Peck & Stanley. (2008). Kemi. (8: e upplagan.). Cengage Learning.
- Morris, J. G. (1974). Fysikalisk för biologer. (2: a upplagan.). Jag reverserade.
- Helmestine, Anne Marie, PH.D. (29 augusti 2020). Svag syrdefinition och exempel i kemi. Återhämtat sig från: tankco.com
- Ophardt C., & McCarthy L. (15 augusti 2020). Syra och basstyrka. Kemi librettexts. Återhämtad från: kem.Librettexts.org
- Clark Jim. (2013). Stark och svag syra. Återhämtat sig från: Chemguide.co.Storbritannien
- Lumeninlärning. (s.F.). Kemi för icke-major: Beräkning av pH av svaga syra- och baslösningar. Återhämtat sig från: kurser.Lumenarning.com

