Indisk

- 4427
- 778
- Per Karlsson
 Metallindisk stycke. Källa: hi-res bilder av kemiska element [cc av (https: // creativecommons.Org/licenser/av/3.0)]
Metallindisk stycke. Källa: hi-res bilder av kemiska element [cc av (https: // creativecommons.Org/licenser/av/3.0)] Vad är indianen?
han Indisk Det är en metall som tillhör grupp 13 i den periodiska tabellen och har en kemisk symbol i. Ditt atomnummer är 49, 49I och presenteras i naturen som två isotoper: 113In och 115I, den senare är den vanligaste. På jorden finns indiska atomer som föroreningar i zink och blymineraler.
Det är en speciell metall, eftersom det är den mjukaste som kan beröras utan många hälsorisker; Till skillnad från litium och rubidium, som skulle bränna huden fruktansvärt när man reagerar med sin fukt. En bit indian kan skäras med en kniv och sprick med fingrarna och avger en distinkt crunch.
Den som hör om denna metall kommer säkert att komma till minnet, men hans namn härstammar från indigofärg, vilket observeras när flamtestet utförs. I detta avseende ser det ut en hel del kalium och bränner sin metall eller dess föreningar med en mycket karakteristisk låga, genom vilken indianen upptäcktes för första gången i Sphenset Minerals.
De indiska delar många kemiska egenskaper med aluminium och gallium och presenterar i de flesta föreningar med ett oxidationsnummer +3 (i3+). Det kombineras utmärkt med Gallien som bildar legeringar med låga smältpunkter, en av dem är Galinstan.
Indiska applikationer är baserade på foder av material med sina legeringar, vilket gör dem till elektriska och flexibla ledare. Indianen har lite glas för att ge dem större glitter och ersätter silver. I teknikvärlden finns indianerna på pekskärmarna och LCD -skärmen.
Upptäckt
1863 letade den tyska kemisten Ferdinand Reich efter spår av Talio -elementet med den gröna linjen i dess emissionspektrum, i CINC -mineraler; Specifikt prover av Sphalerite (ZnS) runt Sachsen. Efter att ha rostat mineralerna, ta bort deras svavelinnehåll, smälta dem i saltsyra och destillera zinkkloriden, erhöll en pajizo -fällning.
Med tanke på upptäckten beslutade Reich att utföra en spektroskopisk analys; Men eftersom han inte hade goda ögon för att observera färgerna, gick han till sin kollega Hariomus Theodor Richter för att hjälpa honom i den här uppgiften. Richter var den som observerade en blåaktig spektrallinje, som inte matchade spektrumet för något annat element.
Det kan tjäna dig: jodosyra (HiO2): egenskaper och användningarDe två tyska kemisterna mötte ett nytt element, som kallades den indiska färgen för flamens indigofärg när deras föreningar brann; Och i sin tur härstammar namnet på denna färg från det latinska ordet Indikera, Vad betyder Indien.
Ett år senare, 1864, upphetsade och efter en långvarig serie nederbörd och rening, isolerade de ett prov av metallindian genom elektrolysen av deras upplösta salter i vatten.
Indisk struktur
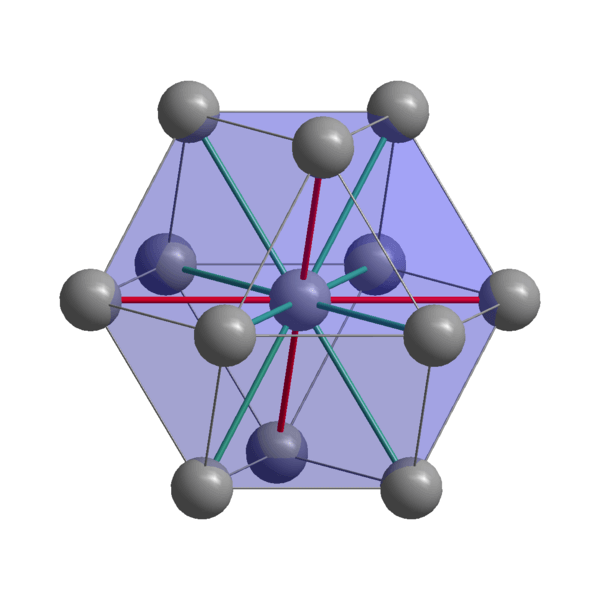 Indisk kristallin struktur
Indisk kristallin struktur Indian, in, sammanhållningsatomer som använder sina valenselektroner för att upprätta en metallbindning. Således beställs de i en förvrängd tetragonal struktur centrerad på kroppen. Interaktioner mellan atomer i-i-i-granar är relativt svaga, vilket förklarar varför indianerna har en låg smältpunkt (156 ºC).
Å andra sidan är de krafter som förenar två eller flera indiska kristaller inte heller starka, annars skulle de inte röra sig ovanpå varandra, vilket ger metallens karakteristiska mjukhet.
Indiska egenskaper
Fysiskt utseende
Det är en anmärkningsvärt mjuk silvermetall. Det kan riva med nageltrycket, klippa med en kniv eller repa i ljusa slag på ett pappersark. Det är till och med möjligt att tugga den och deformera den med tänderna, förutsatt att den är plattad. Det är också mycket duktil och formbart, med plastegenskaper.
När den indiska uppvärmda med en fackla avfärdar en låga av en indigofärg, till och med ljusare och mer färgstarka än kaliumet för kalium.
Molmassa
114,81 g/mol
Smältpunkt
156,60 ºC
Kokpunkt
2072 ºC.
Liksom Gallien har indianen ett stort temperaturintervall mellan sin fusionspunkt och kokningen. Detta återspeglar det faktum att In-in-interaktioner i vätskan är starkare än de som dominerar i glaset; Och därför är det lättare att få en droppe indian än deras ångor.
 Indisk plats i det periodiska bordet. Källa: Daniel Mayer eller Greatpatton Vectorization: Sushant Savla, CC BY-SA 3.0, via Wikimedia Commons
Indisk plats i det periodiska bordet. Källa: Daniel Mayer eller Greatpatton Vectorization: Sushant Savla, CC BY-SA 3.0, via Wikimedia Commons Densitet
Vid rumstemperatur: 7,31 g/cm3
Rätt vid smältpunkten: 7.02 g/cm3
Elektronnegativitet
1,78 på Pauling -skalan
Joniseringsenergier
Först: 558,3 kJ/mol
Andra: 1820,7 kJ/mol
Tredje: 2704 kJ/mol
Värmeledningsförmåga
81,8 W/(M · K)
Elektrisk resistans
83,7 nΩ · m
Mohs hårdhet
1.2. Det är knappt lite svårare än talk (inte förvirrande uthållighet hårt).
Reaktivitet
Den indiska upplöses i syror för att orsaka salter, men löses inte upp i alkaliska lösningar, även med varm kaliumhydroxid. Reagerar i direktkontakt med svavel, syre och halogener.
Kan tjäna dig: utspädning: koncept, hur det görs, exempel, övningarIndianen är relativt amfoterisk, men uppträder mer som grund än som syra, är dess något grundläggande vattenhaltiga lösningar. In (OH)3 Det är omförvandlat med tillägget av fler alkalier som orsakar indierade komplex, i (OH)4-, som med aluminater.
Elektronisk konfiguration
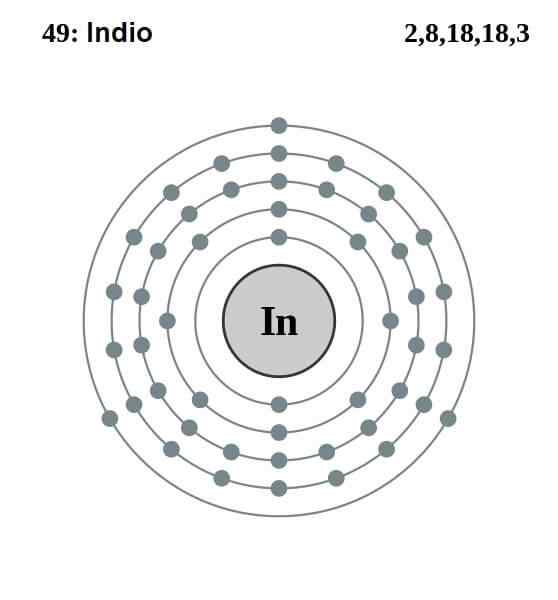 Elektronisk indisk konfiguration
Elektronisk indisk konfiguration Indianens elektroniska konfiguration är som följer:
[KR] 4d10 5S2 5 p1
Av de tretton elektronerna är de sista tre av 5 -tals- och 5p -orbitalerna de i Valencia. Med dessa tre elektroner etablerar indiska atomer sin metallbindning, som aluminium och gallium gör, och bildar kovalenta bindningar med andra atomer.
Oxidationsnummer
Ovanstående används för att stå på en gång att indianen kan förlora sina tre elektroner i Valencia, eller vinna fem för att bli isolektroniska till Noble Gas Xenon.
Om vi i en förening antar att den har tappat sina tre elektroner kommer den att förbli som den trivalenta katjonen3+ (I analogi al3+ och ga3+) och därför kommer ditt oxidationsnummer att vara +3. De flesta indiska föreningar är i (iii).
Bland andra oxidationsnummer som finns för indianerna har vi: -5 (i5-), -2 (i2-), -1 (i-), +1 (i+) och +2 (i2+).
Några exempel på föreningar i (i) är: inf, inkl, inbr, ini och i2ANTINGEN. Alla är relativt sällsynta föreningar, medan de i (iii) är dominerande: i (OH)3, I2ANTINGEN3, Inkl3, Inf3, etc.
I (i) föreningar är kraftfulla reducerande medel, där in+ donera två elektroner till andra arter för att bli i3+.
Isotoper
Indianen presenteras i naturen som två isotoper: 113In och 115I, vars marköverflöd är 4,28% respektive 95,72%. Därför har vi på jorden många fler atomer av 115I det av 113I. han 115I har ett halvt liv på 4,41 · 1014 år, så bra att det praktiskt betraktas som stabilt, trots att det är en radioisotop.
För närvarande har totalt 37 konstgjorda isotoper av indier, alla radioaktiva och mycket instabila har skapats. Av dem alla är den mest stabila 111I, som har ett halvt liv på 2,8 dagar.
Användning/applikationer
Legeringar
Indianen blir mycket bra med gallium. Båda metallerna bildar legeringar som Mel. Dessutom är indianen också lätt amalgam, med 57% löslighet i kvicksilver.
Kan tjäna dig: ättiksyra (CH3COOH)Indiska legeringar används för att designa silverspeglar utan att ta till silver. När de hälls på ett område i något material fungerar det som en vidhäftande, så att glas, metall, kvarts och keramik kan samlas.
elektronik
 Utan indianen skulle pekskärmarna aldrig ha funnits
Utan indianen skulle pekskärmarna aldrig ha funnits Indianen kommer också överens med Germanio, så hans föreningar läggs till som doping till den germanska nitruro från lysdioderna och reproducerar dessa blandningar blå ljus, lila och gröna. Det är också en del av transistorerna, termistorerna och fotovoltaiska celler.
Det viktigaste av dess föreningar är tenn och indisk oxid, som används som ett glasfoder för att återspegla vissa våglängder. Detta gör att du kan användas i svetglas och i skrapglaset så att de inte värms inuti.
Glas belagda med denna oxid är goda elektricitetsledare; Som den från våra fingrar. Och det är därför det är avsett för tillverkning av pekskärmar, ännu mer aktuell aktivitet på grund av uppkomsten av fler och fler smartphones.
Risker
 Indiskt i fast tillstånd. Källa: W. Oelen, CC BY-SA 3.0, via Wikimedia Commons
Indiskt i fast tillstånd. Källa: W. Oelen, CC BY-SA 3.0, via Wikimedia Commons Indianen representerar inte någon risk för miljön i första hand, som i joner i3+ De sprids inte i märkbara mängder. Det finns ingen information om vad dess inverkan på jordarna skulle vara, vilket påverkar växter och varken i fauna eller hav.
I kroppen är det okänt om jonerna i3+ De har ett visst viktigt deltagande i metabolism i spårmängder. Men när deras föreningar intas är de skadliga för flera organ, varför de betraktas som mycket giftiga ämnen.
I själva verket är ITO -partiklar (tenn och indisk oxid för dess förkortning på engelska: Indiumtennoxid), oumbärligt för tillverkning av skärmar för datorer och smartphones, de kan påverka arbetarnas hälsa negativt, vilket orsakar dem en sjukdom som kallas indiska lungor.
Intaget av dessa partiklar sker framför allt genom inandning och genom kontakt genom huden och ögonen.
Å andra sidan är fina metalliska indiska partiklar benägna att bränna och orsaka bränder om de är staket en värmekälla.

